|
|
|
(16分)氯气在298 K、100 kPa时,在1 L水中可溶解0.09 mol,实?【化学反应与能量】
2016-12-27 10:07:29
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (16分)氯气在298 K、100 kPa时,在1 L水中可溶解0.09 mol,实验测得溶于水 的Cl2约有三分之一与水反应。请回答下列问题:
(1)该反应的化学方程式为________________________________________________;
(2)估算该反应的平衡常数________________________________(列式计算);
(3)在上述平衡体系中加入少量NaCl固体,平衡将向________移动;
(4)如果增大氯气的压强,氯气在水中的溶解度将_______(填“增大”、“减小”或“不变”),平衡将向________移动。
(5)已知:H2CO3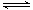 HCO3-+ H+ Ka1(H2CO3) = 4.45×10-7 HCO3-+ H+ Ka1(H2CO3) = 4.45×10-7
HCO3-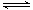 CO32-+ H+ Ka2(H2CO3) = 5.61×10-11 CO32-+ H+ Ka2(H2CO3) = 5.61×10-11
HClO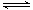 H++ ClO- Ka(HClO) = 2.95×10-8 H++ ClO- Ka(HClO) = 2.95×10-8
请依据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:
将少量的氯气通入到过量的碳酸钠溶液中____________________________________;
(6)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。则下列选项中正确的是 。
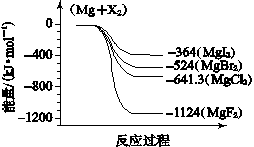
A.MgI2中Mg2+与I-间的作用力小于MgF2中Mg2+与F-间的作用力
B.Mg与X2的反应是放热反应
C.化合物的热稳定性顺序为MgI2>MgBr2>MgCl2>MgF2
D.MgF2(s)+Br2(l)===MgBr2(s)+F2(g) ΔH=+600 kJ·mol- 1
| 依上图数据写出 MgBr2(s)与 Cl2(g)反应的热化学方程式 。
填空题 (16分)氯气在298 K、100 kPa时,在1 L水中可溶解0.09 mol,实验测得溶于水的Cl2约有三分之一与水反应。请回答下列问题:
(1)该反应的化学方程式为________________________________________________;
(2)估算该反应的平衡常数________________________________(列式计算);
(3)在上述平衡体系中加入少量NaCl固体,平衡将向________移动;
(4)如果增大氯气的压强,氯气在水中的溶解度将_______(填“增大”、“减小”或“不变”),平衡将向________移动。
(5)已知:H2CO3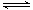 HCO3-+ H+ Ka1(H2CO3) = 4.45×10-7 HCO3-+ H+ Ka1(H2CO3) = 4.45×10-7
HCO3-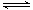 CO32-+ H+ Ka2(H2CO3) = 5.61×10-11 CO32-+ H+ Ka2(H2CO3) = 5.61×10-11
HClO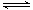 H++ ClO- Ka(HClO) = 2.95×10-8 H++ ClO- Ka(HClO) = 2.95×10-8
请依据以上碳酸和次氯酸的电离平衡常数,写出在下列条件下所发生反应的离子方程式:
将少量的氯气通入到过量的碳酸钠溶液中____________________________________;
(6)下图是金属镁和卤素反应的能量变化图(反应物和产物均为298K时的稳定状态)。则下列选项中正确的是 。

A.MgI2中Mg2+与I-间的作用力小于MgF2中Mg2+与F-间的作用力
B.Mg与X2的反应是放热反应
C.化合物的热稳定性顺序为MgI2>MgBr2>MgCl2>MgF2
D.MgF2(s)+Br2(l)===MgBr2(s)+F2(g) ΔH=+600 kJ·mol- 1
|
依上图数据写出 MgBr2(s)与 Cl2(g)反应的热化学方程式
。
本题答案:(1)Cl2+H2O
氯气与水反应生成盐酸和次氯酸,反应的离子方程式为:Cl2+H2O<img onload='if(this.width>600)makesmallpic(this,600,1800);' src=)
H++Cl-+HClO;
(2)在1L水中可溶解0.09mol氯气,近似氯气浓度为0.09mol/L,则
Cl2+H2O
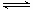
HCl+HClO
起始浓度:0.09 0 0
转化浓度:0.03 0.03 0.03
平衡浓度:0.06 0.03 0.03
则K=(0.03×0.03)÷0.06=0.015mol/L;
(3)在上述平衡体系中加入少量NaCl固体,增大溶液中的氯离子离子,平衡向逆反应方向进行;
(4)在上述平衡中加压,平衡向气体体积减小的反应方向进行,即平衡向正反应方向移动,氯气的溶解量会增加;
(5)根据电离平衡常数可知碳酸的酸性强于次氯酸,但次氯酸的酸性强于碳酸氢根离子的,则将少量的氯气通入到过量的碳酸钠溶液中生成氯化钠、次氯酸钠和碳酸氢钠,离子方程式为Cl2+2CO32-+H2O=Cl-+ClO-+2HCO3-。
(6)A、相同类型的离子晶体中,离子键越大,则离子间作用力越强,物质含有的能量越低,所以MgI2中Mg2+与I-间的作用力小于MgF2中Mg2+与F-间的作用力,故正确;B、根据图象知,反应物的能量大于生成物能量,所以Mg与F2的反应是放热反应,故正确;C、能量越小的物质越稳定,所以化合物的热稳定性顺序为MgI2< MgBr2<MgCl2<MgF2,故错误;D、⑤Mg(s)+F2(l)=MgF2(s)△H-1124kJ/mol,Mg(s)+Br2(l)MgBr2(s)△H-524kJ/mol,将第二个方程式与第一方程式相减得MgF2(s)+Br2(L)MgBr2(s)+F2(g);△H+600kJ?mol-1,故正确;答案为ABD。Mg(s)+Cl2(l)=MgCl2(s)△H=-641kJ/mol,Mg(s)+Br2(l)=MgBr2(s)△H=-524kJ/mol,将第一个方程式减去第二方程式得MgBr2(s)+Cl2(g)=MgCl2(s)+Br2(l)△H=-117KJ?mol-1。
考点:考查平衡常数计算与应用、外界条件对平衡状态的影响;物质结构与性质以及盖斯定律的应用等
本题所属考点:【化学反应与能量】
本题难易程度:【困难】
Friendship is to be strengthened by truth and devotion. 友谊要以真实和忠诚来巩固.
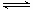 HCl+HClO
HCl+HClO