微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示,已知1 mol SO2(g)被氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。回答下列问题:
2SO3(g)反应过程的能量变化如图所示,已知1 mol SO2(g)被氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。回答下列问题:
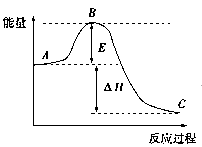
(1)图中A、C分别表示:_________________、__________________;
E的大小对该反应的反应热有无影响?_______________________;
该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?_____________;
理由是__________________________________________。
(2)图中ΔH=______________kJ/mol,该反应是______________反应(填“吸热”“放热”)。
(3)当反应达到平衡时,升高温度,A的转化率 (填“增大”“减小”“不变”)。
(4)发射卫星时可用肼(N2H4)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气。
已知:N2(g)+2O2(g)===2NO2(g) ΔH1=+67.7 kJ/mol;
N 2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH2=-534 kJ/mol。
试计算1 mol肼和二氧化氮完全反应时放出的热量为_______________kJ,写出肼与二氧化氮反应的热化学方程式:___________________________。
填空题 2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示,已知1 mol SO2(g)被氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。回答下列问题:
2SO3(g)反应过程的能量变化如图所示,已知1 mol SO2(g)被氧化为1 mol SO3(g)的ΔH=-99 kJ/mol。回答下列问题:

(1)图中A、C分别表示:_________________、__________________;
E的大小对该反应的反应热有无影响?_______________________;
该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?_____________;
理由是__________________________________________。
(2)图中ΔH=______________kJ/mol,该反应是______________反应(填“吸热”“放热”)。
(3)当反应达到平衡时,升高温度,A的转化率 (填“增大”“减小”“不变”)。
(4)发射卫星时可用肼(N2H4)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气。
已知:N2(g)+2O2(g)===2NO2(g) ΔH1=+67.7 kJ/mol;
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH2=-534 kJ/mol。
试计算1 mol肼和二氧化氮完全反应时放出的热量为_______________kJ,写出肼与二氧化氮反应的热化学方程式:___________________________。
本题答案:(1)反应物能量;生成物能量;没有影响;降低;因为催化剂改变
本题解析:
试题分析:(1)已知SO2和O2反应是放热反应,根据能量守恒得知:反应物的总能量大于生成物的总能量,A是反应物的总能量,C是生成物的总能量;根据盖斯定律反应热只跟始态和终态有关,跟反应的途径无关,E的大小跟反应热大小无关;催化剂改变的反应物的活化能,中学阶段使用催化剂,降低活化分子的活化能,B点会降低。(2)1molSO2被氧化成1molSO3时的反应热△H=-99kJ/mol,2molSO2完全参加反应时放出的热量是2×99=198,△H=-198kJ/mol,是放热反应。(3)根据勒夏特列原理,升高温度,平衡向吸热反应方向移动,SO2转化成SO3是放热 反应,因此升高温度平衡逆向移动,转化率降低。
(4)N2(g)+2O2(g)===2NO2(g) ①;N2H4(g)+O2(g)===N2(g)+2H2O(g)②;
②-①得:2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g)△H=2△H2-△H1=-1135.7kJ/mol,1mol肼和二氧化氮反应时放出的热量是1135.7/2=567.85kJ。
考点:考查反应热计算、盖斯定律等相关知识。
本题所属考点:【化学反应与能量】
本题难易程度:【一般】
Medicines are not meant to live on. 药物可治病,不能当饭吃。