微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (1 4分)X.Y、Z、W是元素周期表前四周期中常见的元素,原子序数依次增大,其相关信息如下表
元素
| 相关信息
|
X
| 由X形成的单质是最清洁的能源
|
Y
| 基态原子核外p能级电子总数比s能级少一个
|
Z
| 由Z形成的多种单质,其中之一是地球生物的“保护伞”
|
W
| 含量位居地壳中金属元素的第二位
|
回答下列问题:
(1)Z位于元素周期表第 周期第 族,W的基态原子核外电子排布式为 。
(2)Y的第一电离能比Z (填“大”或者“小”);由X、Y、Z三种元素组成的一种盐的化学式为 &# 160; 。
(3)写出W元素的单质与X2Z在高温条件下反应的化学方程式 。
(4)在500℃、30MPa下,将1mol X2与足量的Y2置于密闭容器中充分反应生成YX3,当X2的转化率为25%时,放出热量为7.7kJ,则该反应的热化学方程式为: 。
填空题 (1 4分)X.Y、Z、W是元素周期表前四周期中常见的元素,原子序数依次增大,其相关信息如下表
元素
| 相关信息
|
X
| 由X形成的单质是最清洁的能源
|
Y
| 基态原子核外p能级电子总数比s能级少一个
|
Z
| 由Z形成的多种单质,其中之一是地球生物的“保护伞”
|
W
| 含量位居地壳中金属元素的第二位
|
回答下列问题:
(1)Z位于元素周期表第 周期第 族,W的基态原子核外电子排布式为 。
(2)Y的第一电离能比Z (填“大”或者“小”);由X、Y、Z三种元素组成的一种盐的化学式为 。
(3)写出W元素的单质与X2Z在高温条件下反应的化学方程式 。
(4)在500℃、30MPa下,将1mol X2与足量的Y2置于密闭容器中充分反应生成YX3,当X2的转化率为25%时,放出热量为7.7kJ,则该反应的热化学方程式为: 。
本题答案:(14分)
(1)二(1分)VIA(2分) [Ar]3
本题解析:
试题分析:由X形成的单质是最清洁的能源,则X为H元素;Y的基态原子核外p能级电子总数比s能级少一个,则Y基态原子核外电子排布为:1s22s22p3,则Y为N元素;能作为地球生物的“保护伞”的单质为O3,则Z为O元素;W的含量居地壳中金属元素的第二位,则W为Fe元素。
(1)Z为O元素,位于元素周期表第二周期第VIA族;W为Fe元素,原子序数为26,则W的基态原子核外电子排布式为:[Ar]3d64s2(或1s22s22p63s23p63d64s2)。
(2)N原子2p轨道排布了3个电子,为半充满状态,更稳定,N的第一电离能大于O的第一电离能;H、N、O元素可形成NH4NO3或NH4NO2两种盐。
(3)W元素的单质为Fe,X2 Z为H2O,Fe与水蒸气在高温条件下反应生成Fe3O4和H2,化学方程式为:3Fe+4H2O(g) Fe3O4+4H2
Fe3O4+4H2
(4)首先写出N2与H2反应的化学方程式并注明状态,N2(g)+3H2(g)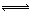 2NH3(g),N2的转化率为25%时,反应了0.25mol的H2,则?H=7.7kJ÷0.25mol×3=—92.4kJ?mol?1,可得热化学方程式。
2NH3(g),N2的转化率为25%时,反应了0.25mol的H2,则?H=7.7kJ÷0.25mol×3=—92.4kJ?mol?1,可得热化学方程式。
考点:本题考查原子结构、电子排布、第一电离能的比较、化学方程式和热化学方程式的书写。
本题所属考点:【化学反应与能量】
本题难易程度:【一般】
Justifying a fault doubles it. 护短是加倍的错误。