微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 氮氧化物是大气污染物之一,消除氮氧化物的方法有多种。
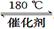
(1)利用甲烷催化还原氮氧化物。已知:
①CH4 (g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H =-574 kJ/mol
②CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g) △H =-1160 kJ/mol
则CH4 将NO2 还原为N2 的热化学方程式为: 。
(2)利用NH3催化还原氮氧化物(SCR技术)。该技术是目前应用最广泛的烟气氮氧化物脱除技术。 反应的化学方程式为: 为提高氮氧化物的转化率可采取的措施是 (写出1条即可)。
为提高氮氧化物的转化率可采取的措施是 (写出1条即可)。
(3)利 用ClO2氧化氮氧化物。其转化流程如下: NO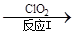 NO2
NO2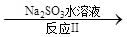 N2。已知反应Ⅰ的化学方程式为2NO+ ClO2 + H2O =NO2 + HNO3 + HCl,则反应Ⅱ的化学方程式是 ;若生成11.2 L N2(标准状况),则消耗ClO2 g 。
N2。已知反应Ⅰ的化学方程式为2NO+ ClO2 + H2O =NO2 + HNO3 + HCl,则反应Ⅱ的化学方程式是 ;若生成11.2 L N2(标准状况),则消耗ClO2 g 。
(4)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g) N2 (g)+CO2 (g)△H.某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2 (g)+CO2 (g)△H.某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度/mol?L-1/
时间/min
| NO
| N2
| CO2
|
0
| 0.100
| 0
| 0
|
10
| 0.058
| 0.021
| 0.021
|
20
| 0.040
| 0.030
| 0.030
|
30
| 0.040
| 0.030
| 0.030
|
40
| 0.032
| 0.034
| 0.017
|
50
| 0.032
| 0.034
| 0.017
|
①T1℃时,该反应的平衡常数K= (保留两位小数).②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是 .③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的△H 0(填“>”、“=”或“<”).
填空题 氮氧化物是大气污染物之一,消除氮氧化物的方法有多种。
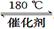
(1)利用甲烷催化还原氮氧化物。已知:
①CH4 (g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H =-574 kJ/mol
②CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g) △H =-1160 kJ/mol
则CH4 将NO2 还原为N2 的热化学方程式为: 。
(2)利用NH3催化还原氮氧化物(SCR技术)。该技术是目前应用最广泛的烟气氮氧化物脱除技术。 反应的化学方程式为: 为提高氮氧化物的转化率可采取的措施是 (写出1条即可)。
为提高氮氧化物的转化率可采取的措施是 (写出1条即可)。
(3)利用ClO2氧化氮氧化物。其转化流程如下: NO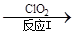 NO2
NO2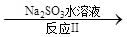 N2。已知反应Ⅰ的化学方程式为2NO+ ClO2 + H2O =NO2 + HNO3 + HCl,则反应Ⅱ的化学方程式是 ;若生成11.2 L N2(标准状况),则消耗ClO2 g 。
N2。已知反应Ⅰ的化学方程式为2NO+ ClO2 + H2O =NO2 + HNO3 + HCl,则反应Ⅱ的化学方程式是 ;若生成11.2 L N2(标准状况),则消耗ClO2 g 。
(4)用活性炭还原法处理氮氧化物.有关反应为:C(s)+2NO(g) N2 (g)+CO2 (g)△H.某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
N2 (g)+CO2 (g)△H.某研究小组向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度/mol?L-1/
时间/min
| NO
| N2
| CO2
|
0
| 0.100
| 0
| 0
|
10
| 0.058
| 0.021
| 0.021
|
20
| 0.040
| 0.030
| 0.030
|
30
| 0.040
| 0.030
| 0.030
|
40
| 0.032
| 0.034
| 0.017
|
50
| 0.032
| 0.034
| 0.017
|
①T1℃时,该反应的平衡常数K= (保留两位小数).②30min后,改变某一条件,反应重新达到平衡,则改变的条件可能是 .③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,则该反应的△H 0(填“>”、“=”或“<”).
本题答案:(1)CH4 (g)+2NO2(g)=N2(g)+CO2(g
本题解析:
试题分析:(1)(①+②)÷2可得CH4 (g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H =-867 kJ/mol。(2)由于反应 的正反应气体体积增大的放热反应。所以提高氮氧化物的转化率可采取的措施可以是通过增大NH3的浓度或减小反应体系的压强或降低反应体系的温度等措施来实施。(3)由题目提供的信息可知NO2与Na2SO3发生氧化还原反应:2NO2 + 4 Na2SO3 =N2 + 4 Na2SO4,从而消除了NOx对环境造成的污染。由方程式得关系式:2ClO2~2NO2~N2。n(N2)=0.5mol,所以n(ClO2)=1mol,m(ClO2)=1mol×67.5g/mol=67.5g。(4)①T1℃时,该反应的平衡常数
的正反应气体体积增大的放热反应。所以提高氮氧化物的转化率可采取的措施可以是通过增大NH3的浓度或减小反应体系的压强或降低反应体系的温度等措施来实施。(3)由题目提供的信息可知NO2与Na2SO3发生氧化还原反应:2NO2 + 4 Na2SO3 =N2 + 4 Na2SO4,从而消除了NOx对环境造成的污染。由方程式得关系式:2ClO2~2NO2~N2。n(N2)=0.5mol,所以n(ClO2)=1mol,m(ClO2)=1mol×67.5g/mol=67.5g。(4)①T1℃时,该反应的平衡常数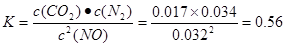 .②由表中数据可以看出30min后,c(CO2)减小,c(N2)却逐渐增加c(NO)有所减少。说明改变的条件是减小c(CO2)。③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,
.②由表中数据可以看出30min后,c(CO2)减小,c(N2)却逐渐增加c(NO)有所减少。说明改变的条件是减小c(CO2)。③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为5:3:3,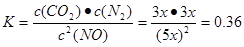 <0.56。说明升高温度,化学平衡向逆反应方向移动。根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动。逆反应方向为吸热反应,所以该反应的正反应为放热反应。则该反应的△H <0.
<0.56。说明升高温度,化学平衡向逆反应方向移动。根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动。逆反应方向为吸热反应,所以该反应的正反应为放热反应。则该反应的△H <0.
考点:考查化学方程式、热化学方程式的书写、化学平衡常数的计算、外界条件对化学平衡移动的影响。
本题所属考点:【有关氧化还 原反应的计算】
本题难易程度:【困难】
Haste trips over its own heels. 匆忙会被自己的脚后跟绊倒. /忙中有错.