微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (14分)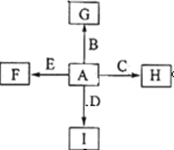
如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,已知:
① 反应C+G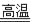 B+H能放出大量的热,G是红综色固体粉末;
B+H能放出大量的热,G是红综色固体粉末;
②I是一种常见的温室气体,它和E可以发生反应:2E+I 2F+D,F中的E元素的质量分数为60%.
2F+D,F中的E元素的质量分数为60%.
回答问题:
(1)①中反应的化学方程式为____________________________________
(2) 1.6g G 溶于盐酸,得到的溶液与铜粉完全反应,至少需要铜粉_______克
(3) C与过 量NaOH溶液反应的离子方程式为________________________,反应后的溶液与过量的化合物I反应的离子方程式为________________________________
(4) E与I反应的化学方程式为__________________________________
(5) 写出H物质在工业上的一种用途_____________。
(6)将一定量的B完全溶于过量盐酸中,然后通入0.005mol Cl2,再加入0.01mol重铬酸钾晶体(K2Cr2O7),恰好使溶液中B2+全部转化为B3+,铬元素本身被还原为+3价铬离子。通过计算确定原B的物质的量为( )
A.0.01mol B.0.03mol C.0.04mol D.0.07mol
填空题 (14分)
如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,已知:
① 反应C+G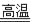 B+H能放出大量的热,G是红综色固体粉末;
B+H能放出大量的热,G是红综色固体粉末;
②I是一种常见的温室气体,它和E可以发生反应:2E+I 2F+D,F中的E元素的质量分数为60%.
2F+D,F中的E元素的质量分数为60%.
回答问题:
(1)①中反应的化学方程式为____________________________________
(2) 1.6g G 溶于盐酸,得到的溶液与铜粉完全反应,至少需要铜粉_______克
(3) C与过量NaOH溶液反应的离子方程式为________________________,反应后的溶液与过量的化合物I反应的离子方程式为________________________________
(4) E与I反应的化学方程式为__________________________________
(5) 写出H物质在工业上的一种用途_____________。
(6)将一定量的B完全溶于过量盐酸中,然后通入0.005mol Cl2,再加入0.01mol重铬酸钾晶体(K2Cr2O7),恰好使溶液中B2+全部转化为B3+,铬元素本身被还原为+3价铬离子。通过计算确定原B的物质的量为( )
A.0.01mol B.0.03mol C.0.04mol D.0.07mol
本题答案:⑴2Al+Fe2O3 ①中是Al与Fe2O3发生的铝热反应,反应的化学方程式为2Al+Fe2O3<img onload='if(this.width>600)makesmallpic(this,600,1800);' src=) 2Fe+Al2O3;(2) G是Fe2O3,1.6g G 的物质的量是1.6g÷160g/mol=0.01mol,溶于盐酸,得到FeCl3溶液与铜粉反应,2FeCl3+Cu= 2FeCl2+ CuCl2,根据Fe守恒可得:n(FeCl3)=0.02mol,则根据方程式可知:其完全反应需要消耗Cu的物质的量是0.01mol,其质量是0.01mol×64g/mol=0.64g。(3) Al与过量NaOH溶液反应的离子方程式为2Al+2OH- + 2H2O==2AlO2-+3H2↑;反应后的溶液是NaAlO2,与过量的化合物I反应的离子方程式为AlO2-+CO2+2H2O = Al(OH)3↓+HCO3-;(5) Al2O3是离子化合物,熔沸点高,可以作耐火材料,也可以用于电解冶炼铝。(6)将一定量的Fe完全溶于过量盐酸中得到FeCl2溶液,然后通入0.005mol Cl2,再加入0.01mol重铬酸钾晶体(K2Cr2O7),恰好使溶液中B2+全部转化为B3+,铬元素本身被还原为+3价铬离子。在氧化还原反应中电子得失数目相等,所以n(Fe2+)×1=n(Cl2)×2+n(K2Cr2O7)×2×3. n(Fe2+)=0.005mol×2+0.01mol×2×3=0.07mol.根据 Fe守恒可知n(Fe)= n(Fe2+)=0.07mol,故选项是D。
2Fe+Al2O3;(2) G是Fe2O3,1.6g G 的物质的量是1.6g÷160g/mol=0.01mol,溶于盐酸,得到FeCl3溶液与铜粉反应,2FeCl3+Cu= 2FeCl2+ CuCl2,根据Fe守恒可得:n(FeCl3)=0.02mol,则根据方程式可知:其完全反应需要消耗Cu的物质的量是0.01mol,其质量是0.01mol×64g/mol=0.64g。(3) Al与过量NaOH溶液反应的离子方程式为2Al+2OH- + 2H2O==2AlO2-+3H2↑;反应后的溶液是NaAlO2,与过量的化合物I反应的离子方程式为AlO2-+CO2+2H2O = Al(OH)3↓+HCO3-;(5) Al2O3是离子化合物,熔沸点高,可以作耐火材料,也可以用于电解冶炼铝。(6)将一定量的Fe完全溶于过量盐酸中得到FeCl2溶液,然后通入0.005mol Cl2,再加入0.01mol重铬酸钾晶体(K2Cr2O7),恰好使溶液中B2+全部转化为B3+,铬元素本身被还原为+3价铬离子。在氧化还原反应中电子得失数目相等,所以n(Fe2+)×1=n(Cl2)×2+n(K2Cr2O7)×2×3. n(Fe2+)=0.005mol×2+0.01mol×2×3=0.07mol.根据 Fe守恒可知n(Fe)= n(Fe2+)=0.07mol,故选项是D。
考点:考查元素及化合物的知识,只有包括物质的推断、性质、用途、化学方程式的书写、守恒法的应用。
本题所属考点:【有关氧化还原反应的计算】
本题难易程度:【一般】
The dictionary is the only place where success comes before work 成功先于工作的唯一地方是在字典里. 注:字典里字母S先于W.