|
|
|
7.6克铜镁合金完全溶解于250mL密度为1.4g/mL、质量分数为63%的浓【有关氧化还原反应的计算】
2016-12-27 12:45:17
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
选择题 7.6克铜镁合金完全溶解于250mL密度为1.4g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体5.6L(标准状况),向反应后的溶液中加入1.0mol/L的KOH溶液,当金属离子全部沉淀时,得到12.7克沉淀。下列说法不正确的是
A.该浓硝酸的物质的量浓度是14.0mol/L
B.得到12.7克沉淀时,加入的KOH溶液的体积是3.2L
C. 该合金中铜与镁的物质的量之比是1:2
D.NO2和N2O4的混合气体中,N2O4的体积分数是20%
|
选择题 7.6克铜镁合金完全溶解于250mL密度为1.4g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体5.6L(标准状况),向反应后的溶液中加 入1.0mol/L的KOH溶液,当金属离子全部沉淀时,得到12.7克沉淀。下列说法不正确的是
A.该浓硝酸的物质的量浓度是14.0mol/L
B.得到12.7克沉淀时,加入的KOH溶液的体积是3.2L
C.该合金中铜与镁的物质的量之比是1:2
D.NO2和N2O4的混合气体中,N2O4的体积分数是20%
|
本题答案:C
本题解析:
试题分析:A.该浓硝酸的物质的量浓度是C=
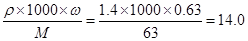
mol/L,正确;C.当金属恰好形成沉淀时在溶液中物质是以KNO3的形式存在。由金属变为金属氢氧化物的沉淀时,增加的质量就是OH-的质量,所以n(OH-)=(12.7g-7.6g)÷17g/mol=0.3mol。则n(e-)=0.3mol,由于铜镁都是+2价的金属,所以n(金属)= 0.15mol,假设原混合物中Cu、Mg的物质的量分别是x、y,则x+y="0.15," 64x+24y=7.6,解得x=0.1mol,y=0.05mol,所以该合金中铜与镁的物质的量之比是2:1,选项C错误;D.在NO2和N2O4的混合气体中,含有NO2和N2O4的物质的量分别是m、n,根据电子守恒可得m+2n=0.3mol;m+n=5.6L÷22.4L/mol。解得m=0.2mol,n=0.05mol,所以在NO2和N2O4的混合气体中,N2O4的体积分数是(0.05÷0.25)×100%=20%,选项D正确。B.在溶液中当金属离子全部沉淀时,得到12.7克沉淀。此时在溶液中N元素的存在形式是KNO3,根据N元素守恒可得n(HNO3)=n(KNO3)+ n(NO2) +2n(N2O4),n(HNO3)=0.25L×14.0mol/L="3.5mol," n(NO2) =0.2mol;2n(N2O4)=2×0.05mol=0.1mol,所以n(KNO3)=3.5mol-0.2mol-0.1nol=3.2mol,根据K元素守恒可得n(KOH)= n(KNO3)= 3.2mol,所以V(KOH)=3.2mol÷1.0mol/L=3.2L,所以选项B正确。故不正确上的是选项C。
考点:考查物质的量浓度与质量分数的换算、守恒的方法在化学计算中的应用的知识。
本题所属考点:【有关氧化还原反应的计算】
本题难易程度:【一般】
Wisdom first teaches what is right. 智慧首先教人明理.
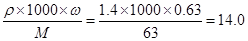 mol/L,正确;C.当金属恰好形成沉淀时在溶液中物质是以KNO3的形式存在。由金属变为金属氢氧化物的沉淀时,增加的质量就是OH-的质量,所以n(OH-)=(12.7g-7.6g)÷17g/mol=0.3mol。则n(e-)=0.3mol,由于铜镁都是+2价的金属,所以n(金属)= 0.15mol,假设原混合物中Cu、Mg的物质的量分别是x、y,则x+y="0.15," 64x+24y=7.6,解得x=0.1mol,y=0.05mol,所以该合金中铜与镁的物质的量之比是2:1,选项C错误;D.在NO2和N2O4的混合气体中,含有NO2和N2O4的物质的量分别是m、n,根据电子守恒可得m+2n=0.3mol;m+n=5.6L÷22.4L/mol。解得m=0.2mol,n=0.05mol,所以在NO2和N2O4的混合气体中,N2O4的体积分数是(0.05÷0.25)×100%=20%,选项D正确。B.在溶液中当金属离子全部沉淀时,得到12.7克沉淀。此时在溶液中N元素的存在形式是KNO3,根据N元素守恒可得n(HNO3)=n(KNO3)+ n(NO2) +2n(N2O4),n(HNO3)=0.25L×14.0mol/L="3.5mol," n(NO2) =0.2mol;2n(N2O4)=2×0.05mol=0.1mol,所以n(KNO3)=3.5mol-0.2mol-0.1nol=3.2mol,根据K元素守恒可得n(KOH)= n(KNO3)= 3.2mol,所以V(KOH)=3.2mol÷1.0mol/L=3.2L,所以选项B正确。故不正确上的是选项C。
mol/L,正确;C.当金属恰好形成沉淀时在溶液中物质是以KNO3的形式存在。由金属变为金属氢氧化物的沉淀时,增加的质量就是OH-的质量,所以n(OH-)=(12.7g-7.6g)÷17g/mol=0.3mol。则n(e-)=0.3mol,由于铜镁都是+2价的金属,所以n(金属)= 0.15mol,假设原混合物中Cu、Mg的物质的量分别是x、y,则x+y="0.15," 64x+24y=7.6,解得x=0.1mol,y=0.05mol,所以该合金中铜与镁的物质的量之比是2:1,选项C错误;D.在NO2和N2O4的混合气体中,含有NO2和N2O4的物质的量分别是m、n,根据电子守恒可得m+2n=0.3mol;m+n=5.6L÷22.4L/mol。解得m=0.2mol,n=0.05mol,所以在NO2和N2O4的混合气体中,N2O4的体积分数是(0.05÷0.25)×100%=20%,选项D正确。B.在溶液中当金属离子全部沉淀时,得到12.7克沉淀。此时在溶液中N元素的存在形式是KNO3,根据N元素守恒可得n(HNO3)=n(KNO3)+ n(NO2) +2n(N2O4),n(HNO3)=0.25L×14.0mol/L="3.5mol," n(NO2) =0.2mol;2n(N2O4)=2×0.05mol=0.1mol,所以n(KNO3)=3.5mol-0.2mol-0.1nol=3.2mol,根据K元素守恒可得n(KOH)= n(KNO3)= 3.2mol,所以V(KOH)=3.2mol÷1.0mol/L=3.2L,所以选项B正确。故不正确上的是选项C。