|
|
|
向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质?【有关氧化还原反应的计算】
2016-12-27 12:49:51
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
选择题 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示。已知: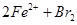 ==2Fe3++2Br-、2Fe3++2I-==2Fe2++I2,下列说法中错误的是 ==2Fe3++2Br-、2Fe3++2I-==2Fe2++I2,下列说法中错误的是
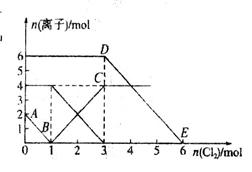
A.还原性:I->Fe2+>Br-
B.线段AB表示Fe2+被氯气氧化
C.线段BC表示生成4 mol F e3+
D.原溶液中n (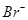 )="6" mol )="6" mol
|
选择题 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示。已知: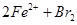 ==2Fe3++2Br-、2Fe3++2I-==2Fe2++I2,下列说法中错误的是 ==2Fe3++2Br-、2Fe3++2I-==2Fe2++I2,下列说法中错误的是

A.还原性:I->Fe2+>Br-
B.线段AB表示Fe2+被氯气氧化
C.线段BC表示生成4 mol Fe3+
D.原溶液中n (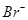 )="6" mol )="6" mol
|
本题答案:B
本题解析:
试题分析:A、反应2Fe2++Br2=2Fe3++2Br-中,还原剂Fe2+的还原性强于还原产物Br-,所以还原性:Fe2+>Br-,反应2Fe3++2I-=2Fe2++I2中,还原剂I-的还原性强于还原产物Fe2+,所以还原性:I->Fe2+,所以还原性I->Fe2+>Br-,故A正确;B、通入氯气后,碘离子先被氧化,其次是亚铁离子,最后是溴离子,在通入氯气的量为0~1mol的过程中,碘离子从最大量降到0,即得到碘离子的物质的量为2mol,通入氯气的量为1~3mol的过程中,亚铁离子从4mol降到0,三价铁的量逐渐增大,所以含有亚铁离子共4mol,在通入氯气的量为3~6mol的过程中溴离子从6ml降到0,所以溴离子的物质的量是6mol,即FeBr2的物质的量为3mol,故B错误;根据以上分析可知CD正确,答案选B。
考点:考查氧化还原反应的有关判断与计算
本题所属考点:【有关氧化还原反应的计算】
本题难易程度:【 91Exam.org一般】
Learning is the light that leads into everything lovely. 学识是照亮通往各种美好事物的道路的明灯.