微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
计算题 (9分)实验室通常用MnO2和浓盐酸共热制取Cl2,反应的化学方程式为
MnO2 + 4HCl(浓) MnCl2 + Cl2↑+ 2H2O。
MnCl2 + Cl2↑+ 2H2O。
(1)该反应的氧化剂是 ,氧化产物是 ,用单线桥法表 示上述反应电子转移方向和数目。
(2)计算当有73.0克HCl完全参加反时,消耗MnO2的物质的量为多少?生成的气体在标准状况下的体积多少升?
计算题 (9分)实验室通常用MnO2和浓盐酸共热制取Cl2,反应的化学方程式为
MnO2 + 4HCl(浓) MnCl2 + Cl2↑+ 2H2O。
MnCl2 + Cl2↑+ 2H2O。
(1)该反应的氧化剂是 ,氧化产物是 ,用单线桥法表示上述反应电子转移方向和数目。
(2)计算当有73.0克HCl完全参加反时,消耗MnO2的物质的量为多少?生成的气体在标准状况下的体积多少升?
本题答案:
(1)MnO2; Cl2 &#
本题解析:
试题解析:(1)由方程式知,Mn元素的化合价降低,则MnO2为氧化剂,Cl元素化合价升高,则氯化氢为还原剂,氯气为氧化产物,Mn元素的化合价由+4价降低为+2价,该反应中转移2e-,转移电子为 ;
;
(2)当有73.0克HCl完全反应时,HCl的物质的量为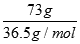 =2mol,由方程式可知消耗MnO2的物质的量为0.5mol,生成氯气的物质的量为0.5mol,标准状况下的体积0.5mol×22.4L/mol=11.2L。
=2mol,由方程式可知消耗MnO2的物质的量为0.5mol,生成氯气的物质的量为0.5mol,标准状况下的体积0.5mol×22.4L/mol=11.2L。
考点:氧化还原反应
本题所属考点:【有关氧化还原反应的 计算】
本题难易程度:【一般】
Better be the head of a dog than the tail of a lion. 宁为鸡口,毋为牛后。