微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (16分)工业上利用废铁屑(含少量氧化铝、氧化铁等)生产硫酸亚铁溶液,进而可制备绿矾(FeSO4·7H2O)、硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐)等重要试剂。生产硫酸亚铁溶液的工艺流程如下:

回答下列问题:
(1)加入少量NaHCO3,调节溶液pH的目的是__________________________。
(2)硫酸亚铁溶液在空气中久置容易变质,用离子方程式表示其变质的原因:_____。
(3)若向所得FeSO4溶液中加入少量3 moL? L-1 H2SO4溶液,再加入饱和(NH4)2SO4溶液,经过蒸发浓缩、冷却结晶、过滤等一系列操作后得到硫酸亚铁铵晶体[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐)。硫酸亚铁铵较绿矾稳定,在氧化还原滴定分析中常用来配制Fe2+的标准溶液。现取0.352g Cu2S和CuS的混合物在酸性溶液中用40.00 mL0.150 mol?L-1 KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2↑+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,剩余的KMnO4恰好与50.00mL 0.200 mol?L-1 (NH4)2Fe(SO4)2溶液完全反应。
①配平离子方程式:MnO4- +Fe2++H+——Mn2++Fe3++H2O
②Cu2S和CuS的混合物在酸性溶液中用0.150 mol?L-1 KMnO4溶液处理后,溶液需煮沸的原因是:_______________________________________________。
③实验室配制500mL 3 moL? L-1 H2SO4溶液,需要质量分数为98%,密度为1.84g? mL-1硫酸的体积为__________ mL。(保留1位小数)
④试计算混合物中CuS的质量分数(写出计算过程)。
填空题 (16分)工业上利用废铁屑(含少量氧化铝、氧化铁等)生产硫酸亚铁溶液,进而可制备绿矾(FeSO4·7H2O)、硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐)等重要试剂。生产硫酸亚铁溶液的工艺流程如下:

回答下列问题:
(1)加入少量NaHCO3,调节溶液pH的目的是__________________________。
(2)硫酸亚铁溶液在空气中久置容易变质,用离子方程式表示其变质的原因:_____。
(3)若向所得FeSO4溶液中加入少量3 moL? L-1 H2SO4溶液,再加入饱和(NH4)2SO4溶液,经过蒸发浓缩、冷却结晶、过滤等一系列操作后得到硫酸亚铁铵晶体[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐)。硫酸亚铁铵较绿矾稳定,在氧化还原滴定分析中常用来配制Fe2+的标准溶液。现取0.352g Cu2S和CuS的混合物在酸性溶液中用40.00 mL0.150 mol?L-1 KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2↑+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2↑+6Mn2++14H2O
反应后煮沸溶液,剩余的KMnO4恰好与50.00mL 0.200 mol?L-1 (NH4)2Fe(SO4)2溶液完全反应。
①配平离子方程式:MnO4-+Fe2++H+——Mn2++Fe 91eXAm.org3++H2O
②Cu2S和CuS的混合物在酸性溶液中用0.150 mol?L-1 KMnO4溶液处理后,溶液需煮沸的原因是:_______________________________________________。
③实验室配制500mL 3 moL? L-1 H2SO4溶液,需要质量分数为98%,密度为1.84g? mL-1硫酸的体积为__________ mL。(保留1位小数)
④试计算混合物中CuS的质量分数(写出计算过程)。
本题答案:(1)除去铝离子,而不使亚铁离子形成沉淀(2分);(2)4F
本题解析:
试题分析:含少量氧化铝、氧化铁等的废铁屑中加入足量的稀硫酸,发生反应:Al2O3+ 3H2SO4= Al2(SO4)3+ 3H2O;Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;Fe+ H2SO4= FeSO4+H2↑,Fe2(SO4)3+ Fe= 3FeSO4。(1)在反应后的溶液中含有FeSO4、Al2(SO4)3,向其中加入少量NaHCO3,调节溶液pH的目的是除去Al3+,Fe2+仍然以离子的形式存在与溶液中;(2)硫酸亚铁溶液在空气中久置容易变质,是因为Fe2+被空气中的氧气氧化为Fe3+.用离子方程式表示是4Fe2+ + O2 + 4H+ =4Fe3+ + 2H2O;(3)①根据电子守恒、电荷守恒及原子守恒可得配平离子方程式是: MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;②Cu2S和CuS的混合物在酸性溶液中用0.150 mol?L-1 KMnO4溶液处理后,反应产生的SO2可能存在与溶液中,若不煮沸赶尽SO2,溶液中的SO2与酸性KMnO4溶液反应,无法准确测定混合物中CuS的质量分数。③质量分数为98%,密度为1.84g? mL-1硫酸的物质的量浓度是C=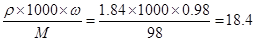 (mol/L)。在溶液的稀释过程中溶质的物质的量不变,所以根据稀释公式C1?V1=C2?V2。在实验室配制500mL 3 moL? L-1 H2SO4溶液,需要质量分数为98%,密度为1.84g? mL-1硫酸的体积为(500mL ×3 moL/L)÷18.4mol/L=81.5ml;④电子守恒有 MnO4-~ 5Fe2+,剩余的KMnO4的物质的量为:50.00×10-3L ×0.2 mol?L-1 ×1/5 = 2.00×10-3 mol。0.352g Cu2S和CuS的混合物反应的KMnO4的物质的量为:40 mL×10-3L ×0.150 mol?L-1- 2.00×10-3 mol = 4.00×10-3 mol。设:Cu2S和CuS的混合物中,Cu2S的物质的量为x,CuS的物质的量为y,则可得方程①160g/mmol x + 96 g/mmoly = 0.352g ;②8/5 x +6/5y = 4.00×10-3 mol。解得x = 1.00×10-3 mol,y = 2.00×10-3 mol,所以混合物中CuS的质量分数为:m(CuS)/m(总) = (2.00×10-3 mol×96 g/mol)/ 0. 352g = 54.5%
(mol/L)。在溶液的稀释过程中溶质的物质的量不变,所以根据稀释公式C1?V1=C2?V2。在实验室配制500mL 3 moL? L-1 H2SO4溶液,需要质量分数为98%,密度为1.84g? mL-1硫酸的体积为(500mL ×3 moL/L)÷18.4mol/L=81.5ml;④电子守恒有 MnO4-~ 5Fe2+,剩余的KMnO4的物质的量为:50.00×10-3L ×0.2 mol?L-1 ×1/5 = 2.00×10-3 mol。0.352g Cu2S和CuS的混合物反应的KMnO4的物质的量为:40 mL×10-3L ×0.150 mol?L-1- 2.00×10-3 mol = 4.00×10-3 mol。设:Cu2S和CuS的混合物中,Cu2S的物质的量为x,CuS的物质的量为y,则可得方程①160g/mmol x + 96 g/mmoly = 0.352g ;②8/5 x +6/5y = 4.00×10-3 mol。解得x = 1.00×10-3 mol,y = 2.00×10-3 mol,所以混合物中CuS的质量分数为:m(CuS)/m(总) = (2.00×10-3 mol×96 g/mol)/ 0. 352g = 54.5%
考点:考查化学操作的目的、离子方程式的书写及配平、溶液的稀释、关系式法、守恒法在关于方程式计算的应用的知识。
本题所属考点:【有关氧化还原反应的计算】
本题难易程度:【困难】
If you make a jest, you must take a jest. 爱开玩笑的人,也要经得住别人开玩笑.