微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (7分)工业尾气SO2、NO2是污染大气、形成酸雨的罪魁祸首。请回答下列问题:
(1)用CO可以消除SO2污染。已知一定条件下,2CO(g)+O2(g)==2CO2(g)的能量变化如图所示,由固体S单质生成l molSO2(g)的焓变为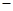 296kJ·mol
296kJ·mol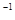 。
。

在相同条件下,CO与SO2反应生成单质S与CO2的热化学方程式为___________________________。
(2)异氰酸(化学式:HNCO,C为+4价)可用于消除尾气中的NO2。其反应原理为:
HNCO+NO2→N2+CO2来源:91考试网 www.91exAm.org+ (未配平)。
(未配平)。
①上述反应的氧化剂是____________。
②配平后方框内应填写____________。
③每处理33.6LNO2(标准状况),反应中转移电子的物质的量为____________。
填空题 (7分)工业尾气SO2、NO2是污染大气、形成酸雨的罪魁祸首。请回答下列问题:
(1)用CO可以消除SO2污染。已知一定条件下,2CO(g)+O2(g)==2CO2(g)的能量变化如图所示,由固体S单质生成l molSO2(g)的焓变为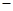 296kJ·mol
296kJ·mol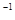 。
。

在相同条件下,CO与SO2反应生成单质S与CO2的热化学方程式为___________________________。
(2)异氰酸(化学式:HNCO,C为+4价)可用于消除尾气中的NO2。其反应原理为:
HNCO+NO2→N2+CO2+ (未配平)。
(未配平)。
①上述反应的氧化剂是____________。
②配平后方框内应填写____________。
③每处理33.6LNO2(标准状况),反应中转移电子的物质的量为____________。
本题答案:(1)2CO(g)+SO2(g)=S(s)+2CO2(g)&
本题解析:
试题分析:(1)根据能量变化关系图可知反应的热化学方程式为① 2CO(g)+O2(g)==2CO2(g) △H=-566kJ/mol。又因为固体S单质生成l molSO2(g)的焓变为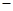 296kJ/mol,则该反应的热化学方程式为②S(s)+O2(g)==SO2(g) △H=-296kJ/mol,则根据盖斯定律可知①-②即得到2CO(g)+SO2(g)=S(s)+2CO2(g) △H=-270kJ/mol;
296kJ/mol,则该反应的热化学方程式为②S(s)+O2(g)==SO2(g) △H=-296kJ/mol,则根据盖斯定律可知①-②即得到2CO(g)+SO2(g)=S(s)+2CO2(g) △H=-270kJ/mol;
(2)①HNCO中C为+4价,则氮元素是-3价。根据方程式可知,反应后NO2中氮元素由+4价降低到0价,得到4个电子,NO2是氧化剂。HNCO中氮元素由-3价升高到0价,失去3个电子,作还原剂,所以根据电子得失守恒可知氧化剂与还原剂的物质来源:91考试网 91EXAm.org的量之比是3:4。根据原子守恒可知还有水生成,因此配平的化学方程式为8HNCO+6NO2=7N2+CO2+4H2O。
②根据以上分析可知,配平后方框内应填写4H2O。
③33.6L标准状况下NO2的物质的量是33.6L÷22.4L/mol=1.5mol,反应中得到1.5mol×4=6mol电子。
考点:考查盖斯定律的应用以及氧化还原反应的有关判断、配平与计算
本题所属考点:【有关氧化还原反应的计算】
本题难易程度:【一般】
He is not to be subdued by force nor swerved by poverty. 威武不能屈,贫贱不能移.