微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (12分)工业上以铬铁矿(主要成分FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O)的主要反应如下:
①4FeO·Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
②2Na2CrO4+H 2SO4 Na2SO4+Na2Cr2O7+H2O
Na2SO4+Na2Cr2O7+H2O
(1)工业上反应①需不断搅拌,其目的是 。
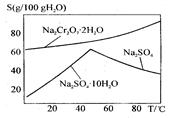
(2)下图是红矾钠(Na2Cr2O7·2H2O)和Na2SO4的溶解度曲线。
从N来源:www.91exam.orga2Cr2O7和Na2SO4的混合溶液中提取Na2Cr2O7晶体的操作:
先将混合溶液蒸发结晶,趁热过滤。趁热过滤的目的是 ;然后将滤液 ,从而析出红矾钠。
(3)Na2Cr2O7与KCl进行复分解反应可制取K2Cr2O7,现用重铬酸钾测定铁矿石中铁的含量,测定原理为:Fe2++Cr2O72-+H+ Fe3++ Cr3+ +7H2O (未配平)
Fe3++ Cr3+ +7H2O (未配平)
实验步骤如下:
步骤1:将m g铁矿石加浓盐酸加热溶解 步骤2:加入SnCl2溶液将Fe3+还原
步骤3:将所得溶液冷却,加入HgCl2溶液,将过量的Sn2+氧化为Sn4+
步骤4:加入15 mL硫酸和磷酸的混合酸及5滴0.2%二苯胺磺酸钠指示剂
步骤5:立即用c mol·L-1重铬酸钾溶液滴定至溶液呈稳定紫色,即为终点,消耗重铬酸钾溶液V mL
①如省去步骤③,则所测定的铁的含量 (填“偏高”、“偏低”或“无影响”)。
②步骤5使用的主要玻璃仪器有 。
③则测定铁矿石中铁的含量的计算式为 (用字母表示,不用化简)。
填空题 (12分)工业上以铬铁矿(主要成分FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O)的主要反应如下:
①4FeO·Cr2O3+8Na2CO3+7O2 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
②2Na2CrO4+H 2SO4 Na2SO4+Na2Cr2O7+H2O
Na2SO4+Na2Cr2O7+H2O
(1)工业上反应①需不断搅拌,其目的是 。
(2)下图是红矾钠(Na2Cr2O7·2H2O)和Na2SO4的溶解度曲线。

从Na2Cr2O7和Na2SO4的混合溶液中提取Na2Cr2O7晶体的操作:
先将混合溶液蒸发结晶,趁热过滤。趁热过滤的目的是 ;然后将滤液 ,从而析出红矾钠。
(3)Na2Cr2O7与KCl进行复分解反应可制取K2Cr2O7,现用重铬酸钾测定铁矿石中铁的含量,测定原理为:Fe2++Cr2O72-+H+ Fe3++ Cr3+ +7H2O (未配平)
Fe3++ Cr3+ +7H2O (未配平)
实验步骤如下:
步骤1:将m g铁矿石加浓盐酸加热溶解 步骤2:加入SnCl2溶液将Fe3+还原
步骤3:将所得溶液冷却,加入HgCl2溶液,将过量的Sn2+氧化为Sn4+
步骤4:加入15 mL硫酸和磷酸的混合酸及5滴0.2%二苯胺磺酸钠指示剂
步骤5:立即用c mol·L-1重铬酸钾溶液滴定至溶液呈稳定紫色,即为终点,消耗重铬酸钾溶液V mL
①如省去步骤③,则所测定的铁的含量 (填“偏高”、“偏低”或“无影响”)。
②步骤5使用的主要玻璃仪器有 。
③则测定铁矿石中铁的含量的计算式为 (用字母表示,不用化简)。
本题答案:(1)使反应物接触更充分,加快反应速率(2分)
(2)
本题解析:
试题分析:(1)工业上反应①需不断搅拌,其目的是使反应物接触更充分,加快反应速率;(2)根据图像可知红矾钠(Na2Cr2O7·2H2O)和的溶解度随温度的升高而增大,而Na2SO4的溶解度在温度是50℃下温度越高,溶解度越大;当温度超过50℃时,温度越高,溶解度反而越小。所以先将混合溶液蒸发结晶,趁热过滤。趁热过滤的目的是除去析出Na2SO4的晶体,又能防止Na2Cr2O7·2H2O因冷却结晶析出而损失;然后将滤液冷却结晶,而析出红矾钠;(3)①如省去步骤③,则在反应过程中Sn2+氧化也需要消耗氧化剂重铬酸钾,因此会导致Fe的含量偏高;②步骤5是滴定操作,应该使用的仪器有盛装有强氧化性的物质重铬酸钾溶液的 酸式滴定管,以及进行物质含量测定的反应容器锥形瓶;③6Fe2++Cr2O72-+14H+ ="=" 6Fe3++ 2Cr3+ +7H2O 。n(重铬酸钾)=" c" mol/L×V mL×10-3L/ml=cv×10-3mol;由于在氧化还原反应中电子守恒,所以n(Fe2+)=6n(Cr2O72-)= 6cv×10-3mol.则测定铁矿石中铁的含量的计算式为[(6cv×10-3mol)×56g/mol]÷m g=56×6VC/1000m。
考点:考查影响化学反应速率的因素、混合物分离的方法、滴定方法在物质含量测定中的应用、误差分析的知识。
本题所属考点:【有关氧化还原反应的计算】
本题难易程度:【困难】
A beard well lathered is half shaved. 皂沫涂得好,胡须半剃掉. /磨刀不误砍柴工.