|
|
|
已知含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的【有关氧化还原反应的计算】
2016-12-27 13:28:36
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
选择题 已知含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,则下列判断不正确的是
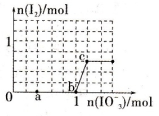
A.还原性:HSO3->I-,氧化性:IO3->I2>SO42-
B.a点处的氧化产物是SO42-,还原产物是I-
C.当溶液中的I-为0.4mol时,加入的KIO3一定为0.4mol
D.若向KIO3溶液中滴加NaHSO3溶液,反应开始时的离子方程式为:2IO3-+5HSO3-=I2+5SO42-+3H++H2O
|
91ExaM.org
选择题 已知含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示,则下列判断不正确的是

A.还原性:HSO3->I-,氧化性:IO3->I2>SO42-
B.a点处的氧化产物是SO42-,还原产物是I-
C.当溶液中的I-为0.4mol时,加入的KIO3一定为0.4mol
D.若向KIO3溶液中滴加NaHSO3溶液,反 应开始时的离子方程式为:2IO3-+5HSO3-=I2+5SO42-+3H++H2O
|
本题答案:C
本题解析:
试题分析:根据图像可知开始阶段没有碘生成,这说明首先发生的反应应该是IO3-+3HSO3-=I-+3SO42-+3H+。在氧化还原反应中还原剂的还原性强于还原产物的还原性,因此还原性HSO-3>I-;继续加入KIO3,出现单质碘,这说明此时发生的反应为IO3-+6H++5I-=3H2O+3I2。在氧化还原反应中氧化剂的氧化性强于氧化产物的氧化性,因此氧化性IO3->I2。则 A、根据以上分析可知还原性:HSO3->I-,氧化性:IO3->I2>SO42-,A正确;B、a点处亚硫酸氢钠过量,则氧化产物是SO42-,还原产物是I-,B正确;C、3mol亚硫酸氢钠最多消耗1mol碘酸钾,产生1mol碘离子,但碘酸钾可以氧化碘离子,所以当溶液中的I-为0.4mol时,加入的KIO3不一定为0.4mol,C错误;D、根据以上分析可知若向KIO3溶液中滴加NaHSO3溶液,碘酸钾过量,可以生成单质碘,因此反应开始时的离子方程式为2IO3-+5HSO3-=I2+5SO42-+3H++H2O,D正确,答案选C。
考点:考查离子反应、氧化还原反应的有关判断与计算
本题所属考点:【有关氧化还原反应的计算】
本题难易程度:【困难】
No song, no supper. 不出力,不得食.