|
|
|
利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除?【有关氧化还原反应的计算】
2016-12-27 13:48:25
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
选择题 利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。下列说法不正确的是
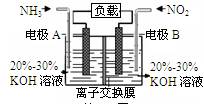
A.电流从右侧电极经过负载后流向左侧电极
B.A电极上发生氧化反应,B为正极
C.电极A极反应式为2NH3-6e-=N2+6H+
D.当有2.24LNO2(标准状况) 被处理时,转移电子为0.4mol
|
选择题 利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。下列说法不正确的是

A.电流从右侧电极经过负载后流向左侧电极
B.A电极上发生氧化反应,B为正极
C.电极A极反应式为2NH3-6e-=N2+6H+
D.当有2.24LNO2(标准状况) 被处理时,转移电子为0.4mol
|
本题答案:C
本题解析:
试 题分析:A、根据电池反应的化学方程式可知氨气中N元素的化合价升高,被氧化,所以通入氨气的一极为负极,则右端为正极,所以电流从右侧电极经过负载后流向左侧电极,正确;B、A为负极,发生氧化反应,B是正极,发生还原反应,正确;C、电极A发生的反应是氨气失去电子生成氮气,因为电解质溶液为KOH溶液,所以氨气失去电子与氢氧根离子结合为水,电极反应式是2NH3-6e-+6OH-=N2+6H2O,错误;D、标准状况下2.24L二氧化氮的物质的量是0.1mol,N元素的化合价从+4价降低到0价,得到4个电子,则0.1mol二氧化氮参加反应时得到0.4mol电子,即转移电子的物质的量是0.4mol,正确,答案选C。
考点:考查电化学反应原理的应用
本题所属考点:【有关氧化还原反应的计算】
本题难易程度:【困难】
Laugh before breakfast and you'll cry before supper. 笑得早也会哭得早。