|
|
|
(14分)硝酸是一种重要的化工原料,工业上生产硝酸的主要过程如【有关氧化还原反应的计算】
2016-12-27 13:52:38
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (14分)硝酸是一种重要的化工原料,工业上生产硝酸的主要过程如下:
(1)以N2和H2为原料合成氨气: N2(g)+3H 2(g)?2NH3(g) △H<0,一定温度下,在密闭容器中充入1molN2和3molH2发生反应。若容器容积恒定,达到平衡状态时,容器内的压强是原来的 ,则N2的转化率a1=_______;若容器压强恒定,达到平衡状态时,N2的转化率为a2,则a2______a1(填“>”、“<”或“=”)。 ,则N2的转化率a1=_______;若容器压强恒定,达到平衡状态时,N2的转化率为a2,则a2______a1(填“>”、“<”或“=”)。
(2)以氨气、空气为主要原料制硝酸:
①NH3被氧气催化氧化生成NO的反应的化学方程式是___________________________________;
②在容积恒定的密闭容器中进行反应2NO(g)+O2(g)?2NO2(g)△H>0 该反应的反应速率(v)随时间(t)变化的关系如图所示,若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号)_______________;
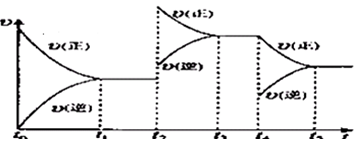
a.在t1~t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施一定是升高温度
c.在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t0~t5时,容器内NO2的体积分数在t3时值的最大
③向容积相同、温度分别为T1和T2的两个密闭容器中分别充入等量NO2发生反应:
2NO2(g)?N2O4(g) △H<0,恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1、a2,已知T1<T2,则a1_______a2
A.大于
B.小于
C.等于
D.以上都有可能
| (3)硝酸厂常用如下2种方法处理尾气:
①催化还原法:催化剂存在时用H2将NO2还原为N2;
已知:2H2(g)+O2(g)=2H2O(g) △H=
填空题 (14分)硝酸是一种重要的化工原料,工业上生产硝酸的主要过程如下:
(1)以N2和H2为原料合成氨气: N2(g)+3H2(g)?2NH3(g) △H<0,一定温度下,在密闭容器中充入1molN2和3molH2发生反应。若容器容积恒定,达到平衡状态时,容器内的压强是原来的 ,则N2的转化率a1=_______;若容器压强恒定,达到平衡状态时,N2的转化率为a2,则a2______a1(填“>”、“<”或“=”)。 ,则N2的转化率a1=_______;若容器压强恒定,达到平衡状态时,N2的转化率为a2,则a2______a1(填“>”、“<”或“=”)。
(2)以氨气、空气为主要原料制硝酸:
①NH 3被氧气催化氧化生成NO的反应的化学方程式是___________________________________;
②在容积恒定的密闭容器中进行反应2NO(g)+O2(g)?2NO2(g)△H>0 该反应的反应速率(v)随时间(t)变化的关系如图所示,若t2、t4时刻只改变一个条件,下列说法正确的是(填选项序号)_______________;

a.在t1~t2时,可依据容器内气体的压强保持不变判断反应已达到平衡状态
b.在t2时,采取的措施一定是升高温度
c.在t3~t4时,可依据容器内气体的密度保持不变判断反应已达到平衡状态
d.在t0~t5时,容器内NO2的体积分数在t3时值的最大
③向容积相同、温度分别为T1和T2的两个密闭容器中分别充入等量NO2发生反应:
2NO2(g)?N2O4(g) △H<0,恒温恒容下反应相同时间后,分别测定体系中NO2的百分含量分别为a1、a2,已知T1<T2,则a1_______a2
A.大于
B.小于
C.等于
D.以上都有可能
|
(3)硝酸厂常用如下2种方法处理尾气:
①催化还原法:催化剂存在时用H2将NO2还原为N2;
已知:2H2(g)+O2(g)=2H2O(g) △H=
本题答案:
本题解析:
本题所属考点:【有关氧化还原反应的计算】
本题难易程度:【困难】
He that doth most at once doth least. 越想一次做完最多,越是做得最少. /欲速则不达.