微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (12分)铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。
(1)在一定温度下,氧化铁可以与一氧化碳发生下列反应:
Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) △H>0。
2Fe(s)+3CO2(g) △H>0。
①该反应的平衡常数表达式为K=________________;
②该温度下,在2L盛有Fe2O3粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。则10min内CO的平均反应速率为_____________________;
(2)某些金属氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应。下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是__________;
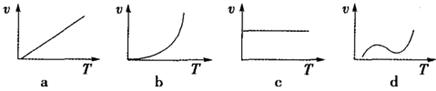
(3)三价铁盐和铝盐在性质上有很多相似的地方,如遇碱都生成难溶的胶状沉淀,可用于净水;也有不同之处,如Fe3+既有氧化性又有还原性,Al3+只有氧化性.但Fe3+只有在碱性介质中才能被氧化为FeO42-,请完成下列化学方程式:
_____Fe(OH)3+___ClO-+____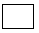 =____FeO42-+___Cl-+____
=____FeO42-+___Cl-+____ ;
;
(4)若将ag Fe和Al的混合物溶于2mol/L足量的硫酸中,再往溶液中加入足量的6mol/L的NaOH溶液,充分反应,过滤、洗涤、干燥灼烧,称量所得固体的质量仍为ag,则原混合物中Al的质量分数为_____________。
填空题 (12分)铁和铝是两种重要的金属,它们的单质及化合物有着各自的性质。
(1)在一定温度下,氧化铁可以与一氧化碳发生下列反应:
Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g) △H>0。
2Fe(s)+3CO2(g) △H>0。
①该反应的平衡常数表达式为K=________________;
②该温度下,在2L盛有Fe2O3粉末的密闭容器中通入CO气体,10min后,生成了单质铁11.2g。则10min内CO的平均反应速率为_____________________;
(2)某些金属氧化物粉末和Al粉在镁条的引燃下可以发生铝热反应。下列反应速率(v)和温度(T)的关系示意图中与铝热反应最接近的是__________;
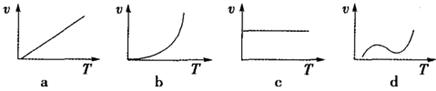
(3)三价铁盐和铝盐在性质上有很多相似的地方,如遇碱都生成难溶的胶状沉淀,可用于净水;也有不同之处,如Fe3+既有氧化性又有还原性,Al3+只有氧化性.但Fe3+只有在碱性介质中才能被氧化为FeO42-,请完成下列化学方程式:
_____Fe(OH)3+___ClO-+____ =____FeO42-+___Cl-+____
=____FeO42-+___Cl-+____ ;
;
(4)若将ag Fe和Al的混合物溶于2mol/L足量的硫酸中,再往溶液中加入足量的6mol/L的NaOH溶液,充分反应,过滤、洗涤、干燥灼烧,称量所得固体的质量仍为ag,则原混合物中Al的质量分数为_____________。
本题答案:(1)①①化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,因此根据方程式可知K=<img onload='if(this.width>600)makesmallpic(this,600,1800);' src=) ;
;
②生成单质铁的物质的量=11.2g÷56g/mol=0.2mol,则分解方程式Fe2O3(s)+3CO(g) 2Fe(s)+3CO2(g)可知消耗CO的物质的量是0.3mol,其浓度是0.3mol÷2L=0.15mol/L,所以CO的反应速率V=0.15mol/L÷10min=0.015mol/(L?min);
2Fe(s)+3CO2(g)可知消耗CO的物质的量是0.3mol,其浓度是0.3mol÷2L=0.15mol/L,所以CO的反应速率V=0.15mol/L÷10min=0.015mol/(L?min);
(2)应用通过加热引发铝热反应,所以开始速率为零,一旦反应,反应放热,温度不断升高,化学反应速率加快,因此图像b符合,答案选b;
(3)在反应中Fe元素化合价由Fe(OH)3中+3价升高为FeO42-中+6价,化合价总升高3价。Cl元素化合价由ClO-中+1价降低为Cl-中-1价,共降低2价,根据电子得失守恒可知化合价最小公倍数为6,所以Fe(OH)3、FeO42-的系数为2,ClO-、Cl-的系数为3,根据题目信息及电荷守恒可知,反应物中缺项为OH-,由原子守恒可知生成物中缺项为H2O,因此配平后方程式为:2Fe(OH)3+3ClO-+4OH-=2FeO42-+3Cl-+5H2O;
(4)Al、Fe混合物与足量硫酸反应后,向溶液中加入足量的NaOH溶液,得到的沉淀为氢氧化铁,将沉淀洗涤,灼烧得到的固体为氧化铁,氧化铁质量与Al、Fe总质量相等,这说明氧化铁中氧元素质 91ExAm.org量等于混合物中Al的质量,故混合物中Al的质量分数=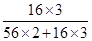 ×100%=30%。
×100%=30%。
考点:考查化学平衡常数、反应速率计算;氧化还原反应方程式配平以及混合物的有关计算等
本题所属考点:【未知】
本题难易程度:【困难】
Light not a candle to the sun. 不要对着太阳点蜡烛。/日既出矣,爝火可熄。