|
|
|
碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在【氧化性和还原性强弱的比较】
2016-12-27 15:46:16
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
选择题 碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种微 粒之间有如图所示关系,根据图示转化关系推测下列说法不正确的是
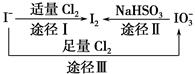
A.可用KI淀粉试纸和食醋检验加碘盐中是否含有碘
B.足量Cl2能使湿润的KI淀粉试纸变白的原因可能是:
5Cl2+I2+6H2O===2HIO3+10HCl
C.由图可知氧化性的强弱顺序为Cl2>I2>IO3-
D.途径Ⅱ中若生成1 mol I2,反应中转移的电子数为10NA
|
选择题 碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种微粒之间有如图所示关系,根据图示转化关系推测下列说法不正确的是

A.可用KI淀粉试纸和食醋检验加碘盐中是否含有碘
B.足 量Cl2能使湿润的KI淀粉试纸变白的原因可能是:
5Cl2+I2+6H2O===2HIO3+10HCl
C.由图可知氧化性的强弱顺序为Cl2>I2>IO3-
D.途径Ⅱ中若生成1 mol I2,反应中转移的电子数为10NA
|
本题答案:C
本题解析:
试题分析:加碘盐中含有IO3-,是高价态物质,有氧化性,根据途径Ⅱ知道在酸性条件下可将I-氧化成I2,淀粉与碘变蓝,A选项正确;根据图可知Cl2可把I2氧化成IO3- B选项正确;根据途径I可知氧化性Cl2>I2,根据途径Ⅱ可知氧化性IO3->I2, C错;IO3-转变为I2转移的电子为10e- ,则生成1 mol I2转移的电子数为10NA D选项正确。选C 。
考点:氧化还原反应中物质氧化性强弱的比较和电子转移的计算。
本题所属考点:【氧化性和还原性强弱的比较】
本题难易程度:【一般】
A fool may give a wise man counsel. 愚人也能为智者出主意. / 愚者千虑,必有一得.