微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (18分)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
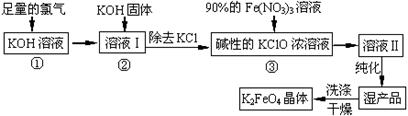
(1)反应①应在温度较低的情况下进行。因在温度较高时KOH 与Cl2反应生成的是KClO3。写出在温度较高时KOH与Cl2反应的化学方程式 ,当反应中转移5 mol电子时,消耗的氯气是 mol。
(2)在反应液I中加入KOH固体的目的是 (填编号)。
A.与反应液I中过量的Cl2继续反应,生成更多 的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使KClO3转化为 KClO
(3)从溶液II中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为 。
(4)如何判断K2FeO4晶体已经洗涤干净 。
(5)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,其离子反应是: FeO42¯ + H2O = Fe(OH)3(胶体) + O2↑ +
完成并配平上述反应的离子方程式。
填空题 (18分)高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:

(1)反应①应在温度较低的情况下进行。因在温度较高时KOH 与Cl2反应生成的是KClO3。写出在温度较高时KOH与Cl2反应的化学方程式 ,当反应中转移5 mol电子时,消耗的氯气是 mol。
(2)在反应液I中加入KOH固体的目的是 (填编号)。
A.与反应液I中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使KClO3转化为 KClO
(3)从溶液II中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为 。
(4)如何判断K2FeO4晶体已经洗涤干净 ; 。
(5)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,其离子反应是: FeO42¯ + H2O = Fe(OH)3(胶体) + O2↑ +
完成并配平上述反应的离子方程式。
本题答案:(1)6KOH+3Cl2在温度较高时KOH与Cl2反应产生KCl、KClO3和水,反应的化学方程式是6KOH+3Cl2<img onload='if(this.width>600)makesmallpic(this,600,1800);' src=) KClO3+5KCl+3H2O;根据方程式可知:当反应中转移5 mol电子时,消耗的氯气的物质的量是3mol;(2)在反应液I中加入KOH固体的目的是与反应液I中过量的Cl2继续反应,生成更多的KClO;为下一步反应提供碱性的环境,故选项是A、C;(3)从溶液II中分离出K2FeO4后,还会有副产品KNO3、KCl,根据电子守恒、电荷守恒及原子守恒可反应③中发生的离子反应方程式为2Fe3+ + 3ClO-+ 10 OH-=2FeO42- + 3Cl-+ 5H2O;(4)如果K2FeO4晶体已经洗涤干净,则表面没有杂质Cl-,因此检验K2FeO4晶体已经洗涤干净的方法是取最后一次的洗涤液,加硝酸银溶液,无白色沉淀则已被洗净;(5)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,其离子反应是:4FeO42- +10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-。
KClO3+5KCl+3H2O;根据方程式可知:当反应中转移5 mol电子时,消耗的氯气的物质的量是3mol;(2)在反应液I中加入KOH固体的目的是与反应液I中过量的Cl2继续反应,生成更多的KClO;为下一步反应提供碱性的环境,故选项是A、C;(3)从溶液II中分离出K2FeO4后,还会有副产品KNO3、KCl,根据电子守恒、电荷守恒及原子守恒可反应③中发生的离子反应方程式为2Fe3+ + 3ClO-+ 10 OH-=2FeO42- + 3Cl-+ 5H2O;(4)如果K2FeO4晶体已经洗涤干净,则表面没有杂质Cl-,因此检验K2FeO4晶体已经洗涤干净的方法是取最后一次的洗涤液,加硝酸银溶液,无白色沉淀则已被洗净;(5)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,其离子反应是:4FeO42- +10H2O=4Fe(OH)3(胶体)+3O2↑+8OH-。
考点:考查反应条件的控制、物质的作用、化学方程式和离子方程式的书写、物质洗涤干净的检验的知识。
本题所属考点:【离子方程式的书写及正误判断】
本题难易程度:【困难】
What's the use of running when you are on the wrong road? 路走错了,跑步又有何用?