微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
选择题 向某NaOH溶液中通入CO2气体后 得到溶液M,因CO2通入的量不同,溶液M的组成也不同,若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图所示。则下列分析与判断 正确的是(不计CO2溶解)
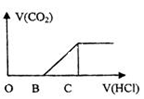
A.若OB=0,则溶液M为Na2CO3溶液
B.若OB=BC,则形成溶液M所发生反应的离子方程式为OH-+CO2 HCO3-
HCO3-
C.若3OB=BC,则溶液M中c(NaHCO3)=2c(Na2CO3)
D.若OB>BC,则溶液M中大量存在的阴离子为CO32-和HCO3-
选择题 向某NaOH溶液中通入CO2气体后 得到溶液M,因CO2通入的量不同,溶液M的组成也不同,若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图所示。则下列分析与判断正确的是(不计CO2溶解)

A.若OB=0,则溶液M为Na2CO3溶液
B.若OB=BC,则形成溶液M所发生反应的离子方程式为OH-+CO2 HCO3-
HCO3-
C.若3OB=BC,则溶液M中c(NaHCO3)=2c(Na2CO3)
D.若OB>BC,则溶液M中大量存在的阴离子为CO32-和HCO3-
本题答案:C
本题解析:
试题分析:A. 若OB=0,由于加入HCl立即产生气体,说明发生反应:NaHCO3+HCl=NaCl+H2O+ CO2↑,说明溶液是NaHCO3溶液,错误;B.若OB=BC,在OB段发生反应:Na2CO3+ HCl="NaCl+" NaHCO3;在BC段发生反应:NaHCO3+HCl=NaCl+H2O+ CO2↑。溶液M是Na2CO3。则形成溶液M所发生反应的离子方程式为2OH-+CO2=HCO3-,错误;C.若3OB=BC,则溶液M的成分是NaHCO3、Na2CO3。在OB段发生 91EXAM.org反应Na2CO3+ HCl="NaCl+" NaHCO3;若Na2CO31mol发生反应消耗盐酸1mol,产生NaHCO31mol;在BC段发生反应NaHCO3+HCl=NaCl+H2O+ CO2↑。NaHCO31mol消耗盐酸1mol,由于3OB=BC,则说明在原溶液中NaHCO3的物质的量是2mol,所以c(NaHCO3)=2c(Na2CO3)。正确;D.若OB>BC,由于BC段发生反应:NaHCO3+HCl=NaCl+H2O+ CO2↑。若只是含有Na2CO3,则OB=BC,现在OB>BC,说明在OB段还发生了反应:NaOH+HCl=NaCl+H2O,则溶液M是Na2CO3、NaOH。该溶液中大量存在的阴离子为CO32-和OH-,错误。
考点:考查NaOH溶液与CO2反应产物的成分的判断的知识。
本题所属考点:【离子方程式的书写及正误判断】
本题难易程度:【一般】
The whole dignity of man lies in the power of thought. 人的全部尊严在于思考的能力.