微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
简答题 (10分)(1)室温下pH=9的NaOH溶液和pH=9的CH3COONa溶液中,设由水电离产生的OH-的物质的量浓度分别为A和B,则A________B(填“>”、“=”或“<”)。
(2)在纯碱溶液中滴入酚酞,溶液变红色,若向该溶液中再滴入过量的BaCl2溶液,所 观察到的现象是_________________________,其原因是_________________________。
(3)对于盐AmBn的溶液:①若为强酸弱碱盐,其水解的离子方程式是_______________。
②若为弱酸强碱盐,其第一步水解的离子方程式是___________________________。
简答题 (10分)(1)室温下pH=9的NaOH溶液和pH=9的CH3COONa溶液中,设由水电离产生的OH-的物质的量浓度分别为A和B,则A________B(填“>”、“=”或“<”)。
(2)在纯碱溶液中滴入酚酞,溶液变红色,若向该溶液中再滴入过量的BaCl2溶液,所观察到的现象是_________________________,其原因是_________________________。
(3)对于盐AmBn的溶液:①若为强酸弱碱盐,其水解的离子方程式是_______________。
②若为弱酸强碱盐,其第一步水解的离子方程式是___________________________。
本题答案:(10分)(1);<
(2)产生白色沉淀,红色逐渐褪去
本题解析:
试题分析:(1)氢氧化钠溶液中,存在大量的氢氧根离子,对水的电离起抑制作用,而醋酸钠溶液中,醋酸根离子水解,对水的电离起促进作用,所以水电离产生的氢氧根离子的浓度A<B;
(2)纯碱为碳酸钠,因为碳酸根离子水解使溶液呈碱性,所以加入酚酞 试液变红色,再滴入氯化钡溶液,因为钡离子与碳酸根离子结合为碳酸钡沉淀,使碳酸根离子的浓度减小,碳酸根离子的水解平衡逆向移动,溶液的碱性减弱,所以红色逐渐褪去,且产生白色沉淀;
(3)对于强酸弱碱盐水解时,弱碱的阳离子水解的离子方程式一步写成,所以水解的离子方程式是An++nH2O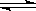 A (OH)n+nH+;对于弱酸强碱盐水解时,弱酸根离子的水解是分步写的,所以第一步水解的离子方程式是Bm-+H2O
A (OH)n+nH+;对于弱酸强碱盐水解时,弱酸根离子的水解是分步写的,所以第一步水解的离子方程式是Bm-+H2O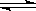 HB (m-1)-+OH-。
HB (m-1)-+OH-。
考点:考查条件对水电离的影响,水解离子方程式的书写
本题所属考点:【离子方程式的书写及正误判断】
本题难易程度:【困难】
Many a little makes a mickle. 积少成多;集腋成裘.