微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 硫元素有多种化合价,可形成多种化合物。
(1)常温下用1mol?L-1 100 mL NaOH溶液恰好完全吸收0.1mol SO2气体,此反应的离子方程式为 &# 160; ;该溶液pH<7的原因是 (结合方程式回答)。以石墨作电极,电解该物质的饱和溶液时,只有一个电极产生气体,写出阳极的电极反应式 。
(2)请按照浓度由大到小的顺序排列0.1mol/LNa2SO3溶液中的离子 。Na2SO3溶液放置于空气中一段时间后,溶液的pH (填“增大”“减小”或“不变”)。
(3)某同学在常温下设计如下实验流程探究Na2S2O3的化学性质。
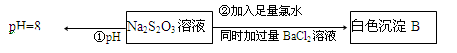
实验①可说明 (填字母)
A.该Na2S2O3溶液中水电离的c(OH—)=10—8mol/L
B.H2S2O3是一种弱酸
C.Na2S2O3是一种弱电解质
D.Na2S2O3水解方程式为S2O32—+2H2O H2S2O3+2OH—
H2S2O3+2OH—
写出实验②发生反应的离子方程式 。
(4)实验室制得的Na2S2O3粗晶体中往往含有少量杂质。为了测定粗产品中Na2S2O3·5H2O的含量,一般采用在酸性条件下用KMnO4标准液滴定的方法(假定粗产品中杂质与酸性KMnO4溶液不反应)。
称取1.28 g的粗样品溶于水,用0.40mol/L KMnO4溶液(加入适量硫酸酸化)滴定,当溶液中S2O32—全部被氧化时,消耗KMnO4溶液体积20.00 mL。
(5S2O32—+8MnO4—+14H+ =8Mn2++10SO42—+7H2O)。试回答:
①此滴定实验是否需要指示剂 (填“是”或“否”),KMnO4溶液置于 (填“酸式”或“碱式”)滴定管中。
②若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的质量分数的测量结果会 (填“偏高”“偏低”或“不变”)。
③产品中Na2S2O3·5H2O的质量分数为 。(Na2S2O3·5H2O式量:248)(保留小数点后两位数)
填空题 硫元素有多种化合价,可形成多种化合物。
(1)常温下用1mol?L-1 100 mL NaOH溶液恰好完全吸收0.1mol SO2气体,此反应的离子方程式为 ;该溶液pH<7的原因是 (结合方程式回答)。以石墨作电极,电解该物质的饱和溶液时,只有一个电极产生气体,写出阳极的电极反应式 。
(2)请按照浓度由大到小的顺序排列0.1mol/LNa2SO3溶液中的离子 。Na2SO3溶液放置于空气中一段时间后,溶液的pH (填“增大”“减小”或“不变”)。
(3)某同学在常温下设计如下实验流程探究Na2S2O3的化学性质。

实验①可说明 (填字母)
A.该Na2S2O3溶液中水电离的c(OH—)=10—8mol/L
B.H2S2O3是一种弱酸
C.Na2S2O3是一种弱电解质
D.Na2S2O3水解方程式为S2O32—+2H2O H2S2O3+2OH—
H2S2O3+2OH—
写出实验②发生反应的离子方程式 。
(4)实验室制得的Na2S2O3粗晶体中往往含有少量杂质。为了测定粗产品中Na2S2O3·5H2O的含量,一般采用在酸性条件下用KMnO4标准液滴定的方法(假定粗产品中杂质与酸性KMnO4溶液不反应)。
称取1.28 g的粗样品溶于水,用0.40mol/L KMnO4溶液(加入适量硫酸酸化)滴定,当溶液中S2O32—全部被氧化时,消耗KMnO4溶液体积20.00 mL。
(5S2O32—+8MnO4—+14H+ =8Mn2++10SO42—+7H2O)。试回答:
①此滴定实验是否需要指示剂 (填“是”或“否”),KMnO4溶液置于 (填“酸式”或“碱式”)滴定管中。
②若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的质量分数的测量结果会 (填“偏高”“偏低”或“不变”)。
③产品中Na2S2O3·5H2O的质量分数为 。(Na2S2O3·5H2O式量:248)(保留小数点后两位数)
本题答案:(1)SO2+OH—=HSO3—;因有HSO3—存在,HSO
本题解析:
试题分析:(1)由已知:n(NaOH)=1mol?L-1 × 0.1L=0.1mol
n(SO2)=0.1mol,则SO2+OH-=HSO3-;
亚硫酸氢钠溶液呈酸性因为:HSO3-?H++SO32-,HSO3-+H2O?H2SO3+OH-
其中电离程度大于水解程度,故亚硫酸氢钠溶液呈酸性;
以石墨作电极,电解该物质的饱和溶液时,阳极H+放电会生成H2,则阳极无气体应为HSO3-放电,电极反应式为:HSO3-+H2O-2e-=SO42-+3H+;
(2)Na2SO3溶液中,SO32-水解显碱性,离子浓度大小比较为:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+),Na2SO3溶液放置于空气中一段时间后被氧化:2Na2SO3+O2=2Na2SO4,溶液从碱性变化为中性,pH减小;
(3)由已知:实验①测定溶液pH=8:
A.溶液pH=8,呈碱性,则c水(OH-)=10-6mol/L,故A错误;
B.S2O32-水解显碱性,证明H2S2O3是弱酸,故B正确;
C.Na2S2O3是钠盐为强电解质,故C错误;
D.H2S2O3为二元弱酸,S2O32-水解应分步进行,故D错误;
实验②Cl2将Na2S2O3氧化为Na2SO4,加BaCl2生成BaSO4反应的离子方程式:
S2O32-+5H2O+4Cl2+Ba2+=2BaSO4↓+8Cl-+10H+;
(4)①由于高锰酸钾溶液呈紫红色可作指示剂,当滴入最后一滴溶液呈紫红色,半分钟不褪色,即可指示出滴定终点。因此不需要指示剂。高锰酸钾为强氧化性溶液,可使用酸式滴定管;
②刚看到溶液局部变色就停止滴定,反应并未达到滴定终点,测得的高锰酸钾溶液体积偏低,因此测量结果会偏低;
③n(KMnO4)="0.40mol/L" ×0.020L=0.008mol,则由反应方程式:
5S2O32-+8MnO4-+14H+=8Mn2++10SO42-+7H2O
5 8
n 0.008mol
n=0.005mol
产品中Na2S2O3?5H2O的质量分数=0.005mol×248g/mol/1.28g×100%=96.9%,
考点:了解盐类水解的原理、影响盐类水解程度的主要因素、盐类水解的应用。了解化学实验是科学探究过程中的一种重要方法。了解化学实验室常用仪器的主要用途和使用方法。能做到设计、评价或改进实验方案。
点评:本题考查了盐类水解应用、 离子浓度大小比较、电解原理及应用、氧化还原滴定及指示剂的确定、实验误差分析等知识点,综合性较强,要求学生熟练掌握基础知识,同时要善于进行知识迁移。
本题所属考点:【离子方程式的书写及正误判断】
本题难易程度:【困难】
The wish is father to the thought. 思考源于愿望. /心有所欲,脑有所思.