微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
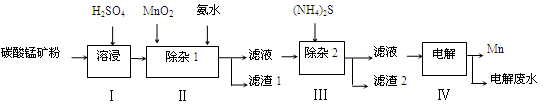
简答题 (12分)锰的用途非常广泛,在钢铁工业中,锰的用量仅次于铁,90%的锰消耗于钢铁工业,10%的锰消耗于有色冶金、化工、电子、电池、农业等部门。以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:
已知25℃,部分物质的溶度积常数如下:
物质
| Mn(OH)2
| Co(OH)2
| Ni(OH)2
| MnS
| CoS
| NiS
|
Ksp
| 2.1×10-13
| 3.0×10-16
| 5.0×10-16
| 1.0×10-11
| 5.0×10-22
| 1.0×10-22
(1)步骤Ⅰ中,MnCO3与硫酸反应的化学方程式是 。
(2)步骤Ⅰ中需要加入稍过量的硫酸,其目的有3点:①使矿物中的物质充分反应;②提供第Ⅱ步氧化时所需要的酸性环境;③ 。
(3)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,该反应的离子方程式是 ,加氨水调节溶液的pH为5.0~6.0,以除去Fe3+。
(4)步骤Ⅲ中,滤渣2的主要成分是 。
(5)步骤Ⅳ中,在 (填“阴”或“阳”)极析出Mn,电极反应方程式为 。
(6)电解后的废水中还含有Mn2+,常用石灰乳进行一级沉降得到Mn(OH)2沉淀,过滤后再向滤液中加入适量Na2S,进行二级沉降。欲使 溶液中c(Mn2+)≤1.0×10-5 mol·L-1,则应保持溶液中c(S2-)≥ mol·L-1。
简答题 (12分)锰的用途非常广泛,在钢铁工业中,锰的用量仅次于铁,90%的锰消耗于钢铁工业,10%的锰消耗于有色冶金、化工、电子、电池、农业等部门。以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:

已知25℃,部分物质的溶度积常数 如下:
物质
| Mn(OH)2
| Co(OH)2
| Ni(OH)2
| MnS
| CoS
| NiS
| Ksp
| 2.1×10-13
| 3.0×10-16
| 5.0×10-16
| 1.0×10-11
| 5.0×10-22
| 1.0×10-22
(1)步骤Ⅰ中,MnCO3与硫酸反应的化学方程式是 。
(2)步骤Ⅰ中需要加入稍过量的硫酸,其目的有3点:①使矿物中的物质充分反应;②提供第Ⅱ步氧化时所需要的酸性环境;③ 。
(3)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,该反应的离子方程式是 ,加氨水调节溶液的pH为5.0~6.0,以除去Fe3+。
(4)步骤Ⅲ中,滤渣2的主要成分是 。
(5)步骤Ⅳ中,在 (填“阴”或“阳”)极析出Mn,电极反应方程式为 。
(6)电解后的废水中还含有Mn2+,常用石灰乳进行一级沉降得到Mn(OH)2沉淀,过滤后再向滤液中加入适量Na2S,进行二级沉降。欲使溶液中c(Mn2+)≤1.0×10-5 mol·L-1,则应保持溶液中c(S2-)≥ mol·L-1。
本题答案:(12分)
(1)MnCO3+H2SO4 =MnSO4
本题解析:
试题分析:(1)碳酸锰与硫酸反应生成硫酸锰、二氧化碳和水,所以化学方程式是MnCO3+H2SO4 =MnSO4+ CO2↑+H2O;
(2)根据表中数据可知氢氧化锰是弱碱,所以硫酸锰水解生成氢氧化锰和硫酸,则硫酸过量的第三个作用是抑制锰离子水解;
(3)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+氧化为Fe3+,二氧化锰被还原为锰离子,离子方程式是MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O;
(4)根据流程图可知,除杂1时,将铁离子除去,则除杂2的目的是除去镍离子和钴离子,根据沉淀的溶度积可知,加入硫化铵后,镍离子和钴离子已硫化物的沉淀除去,所以滤渣2的主要成分是CoS和NiS;
(5)电解时,锰离子在阴极发生还原反应,所以Mn在阴极析出;电极反应式是Mn2++2e-=Mn;
(6)因为KMnS=1.0×10-11,所以欲使溶液中c(Mn2+)≤1.0×10-5 mol·L-1,则应保持溶液中c(S2-)≥KMnS/ c(Mn2+)=1×10-6 mol/L。
考点:考查对工业流程的分析,溶度积的应用,离子方程式的书写
本题所属考点:【离子方程式的书写及正误判断】
本题难易程度:【困难】
What is it that characterizes your personality? ----An unswerving aim. 你的主要特点是什么?-----目标始终如一 |
|