微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
计算题 把48.5 g锌铜合金投入足量盐酸中,恰 好完全反应,得到1 g H2。试计算:
(1)该合金中锌的质量;
(2)该合金中锌、铜的物质的量之比。
计算题 把48.5 g锌铜合金投入足量盐酸中,恰好完全反应,得到1 g H2。试计算:
(1)该合金中锌的质量;
(2)该合金中锌、铜的物质的量之比。
本题答案:(1)32.5 g (2)2∶1
本题解析:
试题分析:n(H2)= =0.5 mol,锌铜合金中只有锌能与盐酸反应生成H2,n(Zn)=n(H2)=0.5 mol。
=0.5 mol,锌铜合金中只有锌能与盐酸反应生成H2,n(Zn)=n(H2)=0.5 mol。
(1)合金中锌的质量m(Zn)=0.5 mol×65 g·mol-1=32.5 g;
(2)合金中铜的质量为48.5 g-32.5 g="16" g,物质的量为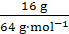 =0.25 mol,锌、铜的物质的量之比为2∶1。
=0.25 mol,锌、铜的物质的量之比为2∶1。
考点:物质的量的计算、化学方程式计算。
本题所属考点:【物质的量】
本题难易程度:【一般】
Time means life,time means speed,time means strength. 时间就是生命,时间就是速度,时间就是力量.