微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
计算题 (10分)实验室在加热条件下制取Cl2的化学方程式为:MnO2+4HCl(浓)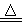 MnCl2+Cl2↑+2H2O。现将17.4 g MnO2投入到400 g质量分数为36.5 %的浓盐酸(浓盐酸过量)中加热,充分反应后(不考虑盐酸挥发),求:
MnCl2+Cl2↑+2H2O。现将17.4 g MnO2投入到400 g质量分数为36.5 %的浓盐酸(浓盐酸过量)中加热,充分反应后(不考虑盐酸挥发),求:
(1)标准状况下生成Cl2的体积为多少?
(2)剩余HCl的物质的量为多少?
计算题 (10分)实验室在加热条件下制取Cl2的化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。现将17.4 g MnO2投入到400 g质量分数为36.5%的浓盐酸(浓盐酸过量)中加热,充分反应后(不考虑盐酸挥发),求:
MnCl2+Cl2↑+2H2O。现将17.4 g MnO2投入到400 g质量分数为36.5%的浓盐酸(浓盐酸过量)中加热,充分反应后(不考虑盐酸挥发),求:
(1)标准状况下生成Cl2的体积为多少?
(2)剩余HCl的物质的量为多少?
本题答案:4.48L;3.2mol
本题解析:
试题解析:8.7MnO2的物质的量=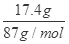 =0.2mol,则:
=0.2mol,则:
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
1 4 1
0.2mol n(HCl) n(Cl2)
n(Cl2)=n(M nO2)==0.2mol,V(Cl2)=22.4L/mol×0.2mol=4.48L;(2)原溶液中氯化氢的物质的量=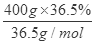 =4mol,反应过程中消耗的氯化氢的物质的量=0.2mol×4=0.8mol,故反应后剩余氯化氢的物质的量=4mol-0.8mol=3.2mol。
=4mol,反应过程中消耗的氯化氢的物质的量=0.2mol×4=0.8mol,故反应后剩余氯化氢的物质的量=4mol-0.8mol=3.2mol。
考点:化学方程式的有关计算
本题所属考点:【物质的量】
本题难易程度:【一般】
There's many a good tune played on an old fiddle. 旧琴也能奏出好乐章.