微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
计算题 (6分)Ⅰ.取1.43g Na2CO3·XH2O 溶于水配成10ml 溶液,然后逐滴滴入稀盐酸直至没有气体放出为止,用去盐酸 2.0ml,并收集到112ml CO2(标况)。
(1)稀盐酸物质的量浓度为___________。
(2)Na2CO3·xH2O的摩尔质量为___________。
(3)x=_______。
Ⅱ.在智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘,化学方程式是:
2NaIO3+5NaHSO3=3NaHSO4+2Na2SO4+I2+H2O
(1)用“双线桥”标出 电子转移的方向和数目。
(2)反应产物中,氧化产物与还原产物的物质的量之比为 。
计算题 (6分)Ⅰ.取1.43g Na2CO3·XH2O 溶于水配成10ml 溶液,然后逐滴滴入稀盐酸直至没有气体放出为止,用去盐酸 2.0ml,并收集到112ml CO2(标况)。
(1)稀盐酸物质的量浓度为___________。
(2)Na2CO3·xH2O的摩尔质量为___________。
(3)x=_______。
Ⅱ.在智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘,化学方程式是:
2NaIO3+5NaHSO3=3NaHSO4+2Na2SO4+I2+H2O
(1)用“双线桥”标出电子转移的方向和数目。
(2)反应产物中,氧化产物与还原产物的物质的量之比为 。
本题答案:Ⅰ. (1)5 mol·L-1(2)286g·mol-1(3
本题解析:
试题分析:Ⅰ.(1)n(CO2)=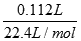 =0.005mol,
=0.005mol,
Na2CO3 + 2HCl = 2NaCl+CO2↑+H2O
1 2 1
n(Na2CO3) n(HCl) 0.005mol
(1)n(HCl)=2×n(CO2)=2×0.005mol=0.01mol,c(HCl)=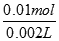 =5.0mol/L,故答案为:5.0mol/L;(2)n(Na2CO3?xH2O)=n(Na2CO3)=0.005mol,M(Na2CO3?xH2O)=286g/mol,故答案为:286g/mol; (3)由摩尔质量可知:106+18x=286,x=10,故答案为:10.
=5.0mol/L,故答案为:5.0mol/L;(2)n(Na2CO3?xH2O)=n(Na2CO3)=0.005mol,M(Na2CO3?xH2O)=286g/mol,故答案为:286g/mol; (3)由摩尔质量可知:106+18x=286,x=10,故答案为:10.
Ⅱ.(1)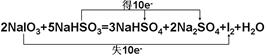
(2)反应中S元素的化合价升高,则S元素失去电子被氧化,生成硫酸钠,I元素的化合价降低,则NaIO3为氧化剂,由化合价变化可知生成1mol氧化产物转移2mol电子,生成1mol还原产物,转移10mol电子,根据转移电子数守恒知,氧化产物与还原产物的物质的量比为5:1.
考点:氧化还原反应
本题所属考点:【物质的量】
本题难易程度:【一般】
Still waters run deep. 静水流深。