微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (14分)铝是一种重要的金属,在生产、生活中具有许多重要的用途,下图是从铝土矿中制备铝的工艺流程:
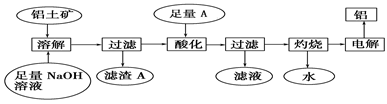
已知:①铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
②溶液中的硅酸钠与四羟基合铝酸钠反应,能生成硅铝酸盐沉淀,化学反应方程式为:
2Na2SiO3+2Na[Al(OH)4]===Na2Al2Si2O8↓+4NaOH+2H2O
回答下列问题:
(1)写出铝土矿中Al2O3与氢氧化钠溶液反应的化学方程式 。
(2)过滤操作用到的玻璃仪器除了烧杯外,还有 。
(3)滤渣A的主要成分为 ;滤渣A的用途是 (写一种)。
( 4)在流程第三步“酸化”中,加入的最佳物质A是___________。理由是_______ ________ 。
(5)将a g镁铝合金投入100mL、1mol/L的盐酸中,金属完全溶解,再加入200mL、1mol/L NaOH溶液,沉淀恰好达到最大值,质量为(a+1.7)g,镁铝合金与盐酸反应时转移的电子数为 。
填空题 (14分)铝是一种重要的金属,在生产、生活中具有许多重要的用途,下图是从铝土矿中制备铝的工艺流程:

已知:①铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
②溶液中的硅酸钠与四羟基合铝酸钠反应,能生成硅铝酸盐沉淀,化学反应方程式为:
2Na2SiO3+2Na[Al(OH)4]===Na2Al2Si2O8↓+4NaOH+2H2O
回答下列问题:
(1)写出铝土矿中Al2O3与氢氧化钠溶液反应的化学方程式 。
(2)过滤操作用到的玻璃仪器除了烧杯外,还有 。
(3)滤渣A的主要成分为 ;滤渣A的用途是 (写一种)。
(4)在流程第三步“酸化”中,加入的最佳物质A是___________。理由是_______ ________ 。
(5)将a g镁铝合金投入100mL、1mol/L的盐酸中,金属完全溶解,再加入200mL、1mol/L NaOH溶液,沉淀恰好达到最大值,质量为(a+1.7)g,镁铝合金与盐酸反应时转移的电子数为 。
本题答案:(1)Al 2O3+2NaOH = 2NaAlO2+H2O(2
本题解析:
试题分析:(1)铝土矿的主要成分Al2O3是两性氧化物,可以与氢氧化钠溶液反应,反应的化学方程式是Al2O3+2NaOH = 2NaAlO2+H2O;(2)过滤操作用到的玻璃仪器除了烧杯外,还有玻璃棒、漏斗;①铝土矿含有Al2O3、SiO2、Fe2O3;当向其中加入足量的NaOH溶液时,发生反应Al2O3+2NaOH = 2NaAlO2+H2O;SiO2+2NaOH =Na2SiO3+H2O;2Na2SiO3+2Na[Al(OH)4]===Na2Al2Si2O8↓+4NaOH+2H2O, Fe2O3不能与NaOH生发生反应,所以滤渣A的主要成分为Fe2O3、Na2Al2Si2O8;滤渣A含有Fe2O3,可以用作冶炼金属Fe;含有Na2Al2Si2O8,是硅酸盐,因此其用途还可以生产硅酸盐产品;(4)在滤液中含有NaAlO2,为了使Al元素完全转化为Al(OH)3沉淀,由于Al(OH)3是两性氢氧化物,能够与强酸发生反应,为了使物质的利用率提高,同时节约成本,流程第三步“酸化”中,加入的最佳物质A是CO2。(5)将a g镁铝合金投入100mL、1mol/L的盐酸中,金属完全溶解,金属失去电子变为MgCl2、AlCl3;当再加入NaOH溶液时,金属阳离子变为Mg(OH)2、Al(OH)3,NaOH溶液200mL、1mol/L,沉淀恰好达到最大值,可见金属失去电子的物质的量与变为金属氢氧化物时结合的OH-的物质的量相等。n(OH-)=1.7g÷17g/mol=0.1mol,所以镁铝合金与盐酸反应时转移的电子数为0.1NA。
考点:考查混合物分离的仪器的使用、化学方程式的书写、物质的成分、守恒方法在化学计算中的作用。
本题所属考点:【物质的量】
本题难易程度:【困难】
Laugh and the world laughs with you,weep and you weep alone. 欢笑,则世界与你同乐;哭泣,则独自悲伤。