微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
实验题 (8分)准确称取12 g铝土矿样品(含Al2O3、Fe2O3、SiO2)放入盛有100 mL某浓度硫酸溶液的烧杯中,充分反应后过滤,向滤液 中加入10 mol·L-1的NaOH溶液,产生的沉淀质量m与加入的NaOH溶液的体积V的关系如图所示:
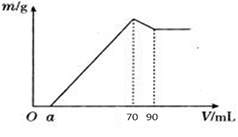
请填空回答:
(1)H2SO4溶液的物质的量浓度为_________________。
(2)若a=4.6,用于沉淀Fe3+消耗NaOH的体积是____________mL,铝土矿中各成分的质量分数:Al2O3为______________, SiO2为______________。
实验题 &nb 91ExAm.orgsp;(8分)准确称取12 g铝土矿样品(含Al2O3、Fe2O3、SiO2)放入盛有100 mL某浓度硫酸溶液的烧杯中,充分反应后过滤,向滤液中加入10 mol·L-1的NaOH溶液,产生的沉淀质量m与加入的NaOH溶液的体积V的关系如图所示:

请填空回答:
(1)H2SO4溶液的物质的量浓度为_________________。
(2)若a=4.6,用于沉淀Fe3+消耗NaOH的体积是____________mL,铝土矿中各成分的质量分数:Al2O3为______________, SiO2为______________。
本题答案:(1)3.5 mol?L-1 (2)5.4 mL&
本题解析:
试题分析:Oa段意味着H2SO4过量,到70 mL时的沉淀最多,有Al(OH)3、Fe(OH)3沉淀,到90 mL时仅剩下Fe(OH)3沉淀。加入20 mL、10 mol·L-1 NaOH,把Al(OH)3↓全部转化成AlO2- 。(1)70 mL时沉淀最多,溶液为Na2SO4溶液,据电荷守恒,n(Na+)=2n(SO42- )。又据元素守恒,n(Na+)="n(NaOH)=10" mol·L-1×0.07 L="0.7" mol,n(SO42-)=n(H2SO4 )=c(H2SO4 )×0.1,所以c(H2SO4 )=3.5 mol?L-1
(2)沉淀Al3+消耗OH-的量,是使Al(OH)3溶解消耗OH-的3倍,即沉淀Al3+消耗NaOH为60 mL,若a=4.6,用于沉淀Fe3+消耗NaOH的体积是70-60-4.6="5.4" mL.
n(Al2O3 )="1/2n(NaOH)=1/2×(10" mol·L-1×0.02 L)="0.1" mol m(Al2O3 )="0.1" mol×102 g/mol="10.2" g
Al2O3的质量分数为=10.2/12×100%=85%,沉淀铁离子消耗NaOH的物质的量为10×0.0054=0.054moL,根据Fe3++3OH-=Fe(OH)3,铁离子的物质的量为0.018moL,Fe2O3的质量分数为[(0.009×160)÷12]×100%=12%,SiO2的质量分数为3%。
考点:考查铝、铁及其化合物的有关计算。
本题所属考点:【物质的量】
本题难易程度:【一般】
Hypocrisy is a homage that vice pays to virtue. 伪善是恶对善的敬重.