微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 准确称取6g铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100mL 稀H2SO4溶液的烧杯中,充分反应后过滤去掉沉淀A, 向滤液中加入10mol/L的KOH溶液,产生沉淀的质量和加入的KOH溶液的体积(mL)如右图所示。试回答下列问题:
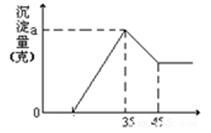
(1)沉淀A是 (填化学式),当加入KOH溶液的体积超过35mL时所发生的反应的离子方程式为 (4分)
(2)铝土矿中Al2O3的物质的量是多少?(2分)
(3)稀硫酸溶液的物质的量浓度为多少?(忽略溶液体积的变化)(2分)
填空题 准确称取6g铝土矿(含Al2O3、Fe2O3、SiO2)样品,放入盛有100mL 稀H2SO4溶液的烧杯中,充分反应后过滤去掉沉淀A,向滤液中加入10mol/L的KOH溶液,产生沉淀的质量和加入的KOH溶液的体积(mL)如右图所示。试回答下列问题:

(1)沉淀A是 (填化学式),当加入KOH溶液的体积超过35mL时所发生的反应的离子方程式为 (4分)
(2)铝土矿中Al2O3的物质的量是多少?(2分)
(3)稀硫酸溶液的物质的量浓度为多少?(忽略溶液体积的变化)(2分)
本题答案:(1)SiO2 ; Al(OH)3+O
本题解析:
试题分析:(1)Al2O3、Fe2O3、SiO2几种物质中SiO2 不和H2SO4溶液反应,故沉淀A是SiO2 ,加入35mL氢氧化钠溶液时,沉淀量最大,此时沉淀为Al(OH)3 ,Fe(OH)3,当KOH溶液的体积超过35mL时Al(OH)3会发生溶解,离子方程式为:Al(OH)3+OH-=2H2O+AlO2- (2)从35mL~45mL段Al(O H)3会发生溶解,该段消耗的n(KOH)=0.01L×10mol/L=0.1mol,根据离子方程式Al(OH)3+OH-=2H2O+AlO2- 可知,氢氧化铝的物质的量为0.1mol则n(Al2O3)=0.05mol,(3)当加入KOH溶液的体积为35mL时沉淀量最大,此时溶液中溶质为K2SO4,根据K元素守恒有n(K2SO4)=1/2 n(KOH)=0.5×0.035L×10mol/L =0.175mol,K2SO4中的SO42-都来自于稀H2SO4,则n(H2SO4)= n(K2SO4)=0.175mol,稀H2SO4的浓度为:c(H2SO4)=n/V= 0.175mol,÷0.1L=1.75mol/L
考点:化学图像的认识、离子方程式的书写、有关物质的量的计算。
本题所属考点:【物质的量】
本题难易程度:【一般】
A friend's frown is better than a fool's smile. 朋友对你皱眉,胜过傻瓜对你微笑.