微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (12分) 硫酸锌被广泛应用于工农业生产和医药领域.工业上由氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)生产ZnSO4·7H2O的一种流程如下:
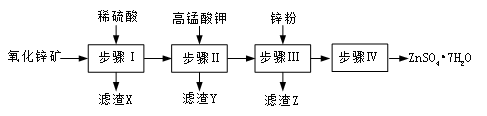
(1)步骤Ⅰ包括酸浸和过滤两个操作。
①酸浸时,需不断通入高温水蒸气的目的是 。
②过滤时为防堵塞,过滤装置需常用NaOH溶液清洗,其清洗原理是 &# 160; (用化学方程式表示)。
(2)步骤Ⅱ中,在pH约为5.1的滤液中加入高锰酸钾,生成Fe(OH)3和MnO(OH)2两种沉淀,该反应的离子方程式为 。
(3)步骤Ⅲ所得滤渣Z的主要成分是 。
(4)取28.70 g ZnSO4·7H2O加热至不同温度,剩余固体的质量变化如下图所示。
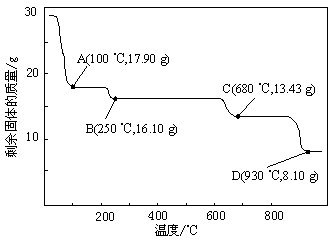
①步骤Ⅳ中的烘干操作需在减压条件下进行,其原因是 。
②在图中C点,680 ℃时所得固体的化学式为 (填字母序号)。
a.ZnO b.ZnSO4 c.ZnSO4·H2O d.Zn3O(SO4)2
d.Zn3O(SO4)2
填空题 (12分) 硫酸锌被广泛应用于工农业生产和医药领域.工业上由氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)生产ZnSO4·7H2O的一种流程如下:

(1)步骤Ⅰ包括酸浸和过滤两个操作。
①酸浸时,需不断通入高温水蒸气的目的是 。
②过滤时为防堵塞,过滤装置需常用NaOH溶液清洗,其清洗原理是 (用化学方程式表示)。
(2)步骤Ⅱ中,在pH约为5.1的滤液中加入高锰 酸钾,生成Fe(OH)3和MnO(OH)2两种沉淀,该反应的离子方程式为 。
(3)步骤Ⅲ所得滤渣Z的主要成分是 。
(4)取28.70 g ZnSO4·7H2O加热至不同温度,剩余固体的质量变化如下图所示。

①步骤Ⅳ中的烘干操作需在减压条件下进行,其原因是 。
②在图中C点,680 ℃时所得固体的化学式为 (填字母序号)。
a.ZnO b.ZnSO4 c.ZnSO4·H2O d.Zn3O(SO4)2
d.Zn3O(SO4)2
本题答案:(14分,每空2分)(1)①升高温度、使反应物充分混合,以加
本题解析:
试题分析:(1)①升高温度反应速率加快,因此酸浸时,需不断通入高温水蒸气的目的是升高温度、使反应物充分混合,以加快反应速率。
②由于反应中产生硅酸,硅酸难溶于水,所以过滤容易防堵塞。由于硅酸能与氢氧化钠溶液反应,因此过滤时用NaOH溶液清洗原理用化学方程式表示为H2SiO3+2NaOH=Na2SiO3+2H2O。
(2)步骤Ⅱ中,在pH约为5.1的滤液中加入高锰酸钾,生成Fe(OH)3和MnO(OH)2两种沉淀,其中铁元素的化合价从+2价升高到+3价,失去1个电子。Mn元素的化合价从+7价降低到+4价,得到3个电子,则根据电子得失守恒可知反应的离子方程式为3Fe2++MnO4-+8H2O=3Fe(OH)3↓+MnO(OH)2↓+5H+。
(3)滤液中含有铜离子,加入锌粉可以把铜置换出来,则步骤Ⅲ所得滤渣Z的主要成分是铜和剩余的锌。
(4)①温度高,硫酸锌晶体易分解,所以步骤Ⅳ中的烘干操作需在减压条件下进行的原因是降低烘干的温度,防止ZnSO4·7H2O分解。
②28.70g晶体的物质的量是28.70g÷287g/mol=0.1mol,A点晶体质量变为17.90g,即减少10.8g,相当于结晶水的物质的量是10.8g÷18g/mol=0.6mol,即A点化学式为ZnSO4·H2O。B点与A点相比固体质量又减少1.8g,说明此时完全失去结晶水,即B点化学式为ZnSO4。C点固体质量为13.43g,如果全部是氧化锌,则氧化锌的质量是8.1g≠13.43g,所以根据以上分析可知在图中C点,680 ℃时所得固体的化学式为Zn3O(SO4)2。
考点:考查物质制备工艺流程图的分析与判断
本题所属考点:【物质的量】
本题难易程度:【困难】
If you want knowledge, you must toil for it. 求知必须刻苦.