微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 化学在环境保护中起着十分重要的作用。催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
(1)催化反硝化法中,H2能将NO3-还原为N2。25℃时,反应进行l0 min,溶液的pH由7变为l 2。
①N2的结构式为
②上述反应的离子方程式为 ,其平均反应速率v(NO3-)为 mol·L-1·min-1。
③还原过程中可生成中间产物NO2-,写出2种促进NO2-水解的方法 。
(2)电化学降解NO3-的原理如下图所示。

①电源正极为 ( 填“A”或“B”),阴极反应式为:
②若电解过程中转移了2 mol电子,则膜两侧电解液的质量变化差(△m左-△m右)为 g。
填空题 &nbs p;化学在环境保护中起着十分重要的作用。催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。
(1)催化反硝化法中,H2能将NO3-还原为N2。25℃时,反应进行l0 min,溶液的pH由7变为l 2。
①N2的结构式为
②上述反应的离子方程式为 ,其平均反应速率v(NO3-)为 mol·L-1·min-1。
③还原过程中可生成中间产物NO2-,写出2种促进NO2-水解的方法 。
(2)电化学降解NO3-的原理如下图所示。

①电源正极为 (填“A”或“B”),阴极反应式为:
②若电解过程中转移了2 mol电子,则膜两侧电解液的质量变化差(△m左-△m右)为 g。
本题答案:(1)①N≡N
本题解析:
试题分析:(1) ②废水不应显酸性(HNO3易挥发),而是中性或碱性,所以O2-在水中以H2O或OH-形式存在,有题意也可看出生成OH-(溶液pH由7变为12),依据氧化还原反应规律可配平:

pH=12 c(H+)=1×10-12mol·L-1
c(H+)=1×10-12mol·L-1
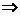 c(OH-)=
c(OH-)=  1×10-2mol·L-1
1×10-2mol·L-1
υ(NO3-)=υ(OH-)= 1×10-10mol·L-1 /10min= 0.001mol·L-1·min-1
③由方程式知NO2-+H2O HNO2+OH-△H>0 ,加热,加酸均可均可使平衡正向移动,促进NO2-转化。
HNO2+OH-△H>0 ,加热,加酸均可均可使平衡正向移动,促进NO2-转化。
(2)①2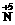 O3-+10e-→
O3-+10e-→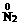 +6O2,所以B极为电源负极,A极为电源正极。
+6O2,所以B极为电源负极,A极为电源正极。
O2-+H2O=2OH-,可以写出阴极反应式:2NO3-+6H2O+10e-= N2↑+12OH-
② 左(+)阳极:4H2O(OH-)-4e-=4H++O2↑+2H2O
右(- )阴极:2NO3-+6H2O+10e-= N2↑+12OH-
10 e-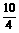 O2(左)- 1N2(右)-10H+
O2(左)- 1N2(右)-10H+
10mol 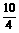 mol 1mol 10mol
mol 1mol 10mol
2mol 0.5mol 0.2mol 2mol
由于阴阳极之间被质子交换膜隔开,左侧电解产生的H+会穿过质子交换膜进入右侧,所以:
△m左=m(O2)+m(H+)=0.5mol×32g·mol-1+2mol×1g·mol-1="18g"
△m右= m(N2)-m(H+)=0.2mol×28g·mol-1-2mol×1g·mol-1=3.6g
△m左-△m右="18g-3.6g" = 14.4g
考点:电解原理及相关计算。
本题所属考点:【化学基本概念】
本题难易程度:【一般】
Be slow in choosing a friend, slower in changing. 选择朋友要慢,换朋友更要慢.