微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 ;(12分)工业上生产高氯酸(沸点:90oC)时还生产了亚氯酸钠,其工艺流程如下:
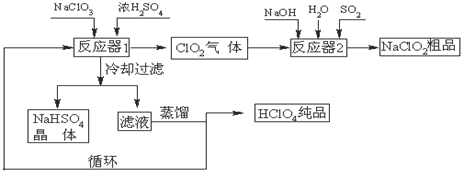
(1)冷却过滤的目的是降低NaHSO4的 ,并分离出NaHSO4晶体。
(2)反应器2中发生反应的离子方程式为 ,SO2的作用是作 剂。
(3)上述工业生产高氯酸的化学反应为:3NaClO3+3H2SO4(浓)=3NaHSO4+HClO4+2ClO2+H2O,氧化产物与还原产物的物质的量之比为 。
(4)可以通过蒸馏滤液的方法得到高氯酸的原因可能是高氯酸的沸点比较 (填“高”或“低”),容易从溶液中逸出,循环使用的物质是 。
填空题 (12分)工业上生产高氯酸(沸点:90oC)时还生产了亚氯酸钠,其工艺流程如下:

(1)冷却过滤的目的是降低NaHSO4的 ,并分离出NaHSO4晶体。
(2)反应器2中发生反应的离子方程式为 ,SO2的作用是作 剂。
(3)上述工业生产高氯酸的化学反应为:3NaClO3+3H2SO4(浓)=3NaHSO4+HClO4+2ClO2+H2O,氧化产物与还原产物的物质的量之比为 。
(4)可以通过蒸馏滤液的方法得到高氯酸的原因可能是高氯酸的沸点比较 (填“高”或“低”),容易从溶液中逸出,循环使用的物质是 。
本题答案:(每空2分,共12分) (1)溶解度 (2)2Cl
本题解析:
试题分析:(1)在反应器1中,硫酸钠和硫酸反应得到硫酸氢钠。冷却过滤可以得到硫酸氢钠晶体,这说明冷却过滤的目的是降低NaHSO4的溶解度,并分离出NaHSO4晶体。
(2)SO2具有还原性,在碱性溶液中能把ClO2还原为NaClO2,反应的离子方程式为2ClO2+SO2+4OH-=2ClO2-+SO42-+2H2O;
(3)根据反应2NaClO3+Na2SO3+H2SO4=2ClO2+2Na2SO4+H2O可知,氯酸钠中氯元素的化合价从+5价降低到+4价,得到1个电子,ClO2是还原产物。亚硫酸钠中S元素的化合价从+ 91ExAm.org4价升高到+6价,失去2个电子,硫酸钠是氧化产物。根据电子得失守恒可知,氧化产物与还原产物的物质的量之比为1:2;
(4)根据题意高氯酸的沸点为90C,沸点比较低,因此可以采用蒸馏滤液的方法得到高氯酸。根据流程图可知现硫酸作为反应物进入反应器1中,又作为生成物在反应器2中生成,因此硫酸可以循环使用。
考点:考查物质制备工艺流程图的分析与应用
本题所属考点:【化学基本概念】
本题难易程度:【困难】
As your wedding-ring wears, your cares will wear away. 结婚戒指戴旧了,烦恼也就消除了.