微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 从回收的含铜电缆废料中提取铜时,假若设计如下两种方案,回答有关问题。
方案甲:??
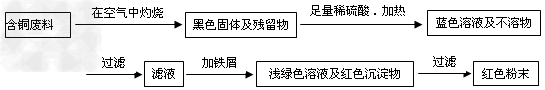
方案乙:??
(1)两个方案中,符合当前生产中绿色化学理念的是方案______,理由是?_________。
(2)方案乙中铜溶解生成蓝色溶液时发生反应的离子方程式为_____________________________,若不考虑绿色化学要求,溶解铜生成硫酸铜时,还可将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使铜溶解完全,则理论上硫酸和硝酸的物质的量之比最佳为:_________︰__________。
(3)为了提高原料的利用率,最后一步所得浅绿色滤液通过蒸发浓缩、冷却结晶、过滤、洗涤、自然干燥可得到一种结晶水合物的晶体。获得晶体后对其进行检测:
①先取a?g的晶体进行脱水实验,获得无水固体为(a—1.26)g ?
②将无水固体溶于足量的水配成溶液后滴加1.00mol/L的氯化钡溶液,当滴加10.00mL溶液时,沉淀恰好完全。通过计算测知该晶体的化学式是?___________。
(4)氯化亚铜(CuCl)是重要的化工原料。国家标准规定合格的CuCl产品的主要质量指标为CuCl的质量分数大于96.5%?。工业上用硫酸铜等原料常通过下列反应制备CuCl?:
2CuSO4+?Na2SO3?+?2?NaCl?+?Na2CO3?=?2?CuCl?↓+?3?Na2SO4?+?CO2↑ 测定CuCl质量分数时先准确称取所制备的0.2500g?CuCl样品置于一定量的0.5mol·L-1?FeCl3?溶液中,待样品完全溶解后,加水20mL,用0.1000 91EXAm.orgmol·L-1?Ce(SO4)2溶液滴定到终点,消耗24.60mL?Ce(SO4)2溶液。有关反应的离子方程式为:???
Fe3+ +CuCl=Fe2+ +Cu2+ +Cl-?,Ce4+?+?Fe?2+?=?Fe?3+?+?Ce3+ ????通过计算说明上述样品中CuCl的质量分数是否符合标准。
填空题 从回收的含铜电缆废料中提取铜时,假若设计如下两种方案,回答有关问题。
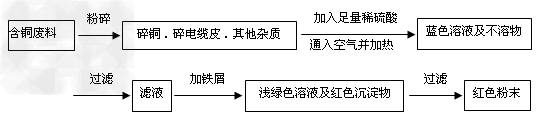
方案甲:??

方案乙:??

(1)两个方案中,符合当前生产中绿色化学理念的是方案______,理由是?_________。
(2)方案乙中铜溶解生成蓝色溶液时发生反应的离子方程式为_____________________________,若不考虑绿色化学要求,溶解铜生成硫酸铜时,还可将适量硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使铜溶解完全,则理论上硫酸和硝酸的物质的量之比最佳为:_________︰__________。
(3)为了提高原料的利用率,最后一步所得浅绿色滤液通过蒸发浓缩、冷却结晶、过滤、洗涤、自然干燥可得到一种结晶水合物的晶体。获得晶体后对其进行检测:
①先取a?g的晶体进行脱水实验,获得无水固体为(a—1.26)g ?
②将无水固体溶于足量的水配成溶液后滴加1.00mol/L的氯化钡溶液,当滴加10.00mL溶液时,沉淀恰好完全。通过计算测知该晶体的化学式是?___________。
(4)氯化亚铜(CuCl)是重要的化工原料。国家标准规定合格的CuCl产品的主要质量指标为CuCl的质量分数大于96.5%?。工业上用硫酸铜等原料常通过下列反应制备CuCl?:
2CuSO4+?N a2SO3?+?2?NaCl?+?Na2CO3?=?2?CuCl?↓+?3?Na2SO4?+?CO2↑ 测定CuCl质量分数时先准确称取所制备的0.2500g?CuCl样品置于一定量的0.5mol·L-1?FeCl3?溶液中,待样品完全溶解后,加水20mL,用0.1000mol·L-1?Ce(SO4)2溶液滴定到终点,消耗24.60mL?Ce(SO4)2溶液。有关反应的离子方程式为:???
Fe3+ +CuCl=Fe2+ +Cu2+ +Cl-?,Ce4+?+?Fe?2+?=?Fe?3+?+?Ce3+ ????通过计算说明上述样品中CuCl的质量分数是否符合标准。
本题答案:(1)乙??;??甲方案第一步“灼烧”会产生污染空气的气体、
本题解析:
本题所属考点:【化学计算】
本题难易程度:【困难】
If at first you don't succeed, try,try,try again. 再接再厉,终会成功.