微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
计算题 在同温同压下,可逆反应:N2O4(g) ?2NO2(g)达到平衡时气体体积是最初体积的1.5倍,则平衡时N2O4的体积分数是多少?
?2NO2(g)达到平衡时气体体积是最初体积的1.5倍,则平衡时N2O4的体积分数是多少?
计算题 在同温同压下,可逆反应:N2O4(g) ?2NO2(g)达到平衡时气体体积是最初体积的1.5倍,则平衡时N2O4的体积分数是多少?
?2NO2(g)达到平衡时气体体积是最初体积的1.5倍,则平衡时N2O4的体积分数是多少?
本题答案:平衡时N2O4的体积分数是33.33%
本题解析:解法一:设原来N2O4为1体积,最后为1.5体积,气体增加了0.5体积,根据差量法知道生成NO2为1体积,消耗的N2O4为0.5体积,剩余的N2O4为0.5体积,所以平衡时N2O4的体积分数为:
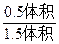 ×100%=33.33%
×100%=33.33%
解法二:设原来N2O4为a体积,则最后为1.5a体积,在反应中消耗了x体积的N2O4,则会生成2x体积的NO2,所以有:
a体积-x体积+2x体积=1.5a体积
x=0.5a
所以平衡时N2O4的体积分数为:
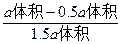 ×100%=33.33%。
×100%=33.33%。
本题所属考点:【反应速率与平衡的有关计算】
本题难易程度:【简单】
The deepest turths are the simplest and the most common. 最深刻的真理是最简单,最普通的道理.