微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (7分)830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g)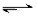 CO2(g)+H2(g)??△H<0试回答下列问题:
CO2(g)+H2(g)??△H<0试回答下列问题:
(1)若起始时c(CO)=2mol·L-1,c(H2O)=3mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=???????????。
(2)在相同温度下,若起始时c(CO)=1mol·L-1,c(H2O)=2mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态?????(填“是”与“否”),此时v(正)???v(逆)(填“大于”“小于”或“等于”),你判断的依据是?????????????????。
( 3)若降低温度,该反应的K值将???????,该反应的化学反应速率将????(均填“增大”“减小”或“不变”)。
填空题 (7分)830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g) 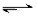 CO2(g)+H2(g)??△H<0试回答下列问题:
CO2(g)+H2(g)??△H<0试回答下列问题:
(1)若起始时c(CO)=2mol·L-1,c(H2O)=3mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=???????????。
(2)在相同温度下,若起始时c(CO)=1mol·L-1,c(H2O)=2mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态?????(填“是”与“否”),此时v(正)???v(逆)(填“大于”“小于”或“等于”),你判断的依据是?????????????????。
(3)若降低温度,该反应的K值将???????,该反应的化学反应速率将????(均填“增大”“减小”或“不变”)。
本题答案:(7分)(1)1 (2)否、大于??因为
![]() 本题解析:
本题解析:
(1)依据平衡计算的三步法,可推知在平衡时CO的浓度为0.8mol/L,H2O浓度为1.8mol/L,CO2浓度为1.2mol/L,H2的浓度为1.2mol/L.再根据K值计算公式得到:K=1.
(2)以0.5mol/LH2来计算,K值是小于1的,所以没有达到平衡状态,由于K值小于1,那说明产物的浓度还需要提高,反应还应朝正方向进行,V正〉V逆.
(3)该反应是一个放热反应,降低温度,平衡正向移动,生成物浓度升高,反应物浓度降低,K值变大.但是降低温度会使分子运动速率减慢,化学反应速率也会减小.
本题所属考点:【反应速率与平衡的有关计算】
本题难易程度:【一般】
He that fights and runs away may live to fight another day. 会战斗会退却的人,才有可能保存自己,他日再战.