微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 .(10分)化学学科中的平衡理论主要内容包括:化学平衡、电离平衡、水解平衡和溶解平衡等四种,且均符合勒夏特列原理。
(1)在固定容积的密闭容器中,反应A(g)+2B(g) 4C(g),
4C(g),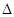 H >0达到平衡时,改变条件重新达到平衡后体系中A的转化率增大,可行的是??? __
H >0达到平衡时,改变条件重新达到平衡后体系中A的转化率增大,可行的是??? __
A.增加B的物质的量????? B.加压???? C.升温????? D.使用催化剂
(2)某溶液是由体积相等的NaOH溶液和醋酸混合而成,且恰好呈中性,则混合前c(NaOH) ____c(CH3COOH),混合后溶液中c(CH3COO-)____c(Na+)
(3)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒(不考虑Zn粒对反应速率的影响),反应过程中两溶液的pH变化如下图所示。

则图中表示醋酸溶液中pH变化曲线的是?????(填A或B)。设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2。则m1?????m2(选填<﹑=﹑>)
来源:91考试网 91eXAm.org
填空题 .(10分)化学学科中的平衡理论主要内容包括:化学平衡、电离平衡、水解平衡和溶解平衡等四种,且均符合勒夏特列原理。
(1)在固定容积的密闭容器中,反应A(g)+2B(g) 4C(g),
4C(g),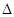 H >0达到平衡时,改变条件重新达到平衡后体系中A的转化率增大,可行的是??? __
H >0达到平衡时,改变条件重新达到平衡后体系中A的转化率增大,可行的是??? __
A.增加B的物质的量????? B.加压???? C.升温????? D.使用催化剂
(2)某溶液是由体积相等的NaOH溶液和醋酸混合而成,且恰好呈中性,则混合前c(NaOH) ____c(CH3COOH),混合后溶液中c(CH3COO-)____c(Na+)
(3)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒(不考虑Zn粒对反应速率的影响),反应过程中两溶液的pH变化如下图所示。

则图中表示醋酸溶液中pH变化曲线的是?????(填A或B)。设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为m2。则m1?????m2(选填<﹑=﹑>)
本题答案:(1)AC(每个1分)???(2)< ;=?????????
本题解析:(1)反应是条件增大、吸热发热可逆反应,所以要增大A的转化率,平衡应该向正反应方向移动,所以选项AC均可以。加压平衡向逆反应方向移动。催化剂不能改变平衡状态。所以正确的答案是AC。
(2)若恰好反应,则 生成物醋酸钠水解显碱性,因此要显中性,醋酸一定是过量的。即氢氧化钠的浓度小于醋酸的。
(3)醋酸是弱电解质,存在电离平衡。在反应过程中会继续电离出氢离子,所以醋酸中氢离子的浓度变化程度小于盐酸。因此要使反应后的pH相等,则醋酸需要的时间就多,即B表示醋酸的。醋酸中消耗的氢离子多,则相应的锌消耗的也就多。
本题所属考点:【反应速率与平衡的有关计算】
本题难易程度:【一般】
Human pride is human weakness. 人类的骄傲即是人类的弱点。