微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (12分)150 ℃时,向如图所示的容器(密封的隔板可自由滑动,整个过程中保持隔板上部压强不变)中加入4 L N2和H2的混合气体,在催化剂作用下充分反应( 催化剂体积忽略不计),反应后恢复到原温度。平衡后容器体积变为3.4 L,容器内气体对相同条件的氢气的相对密度为5。
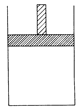
(1)反应前混合气体中V(N2)?:V(H2)=____________;反应达平衡后V(NH3)=____________L;该反应中N2转化率为____________。
(2)向平衡后的容器中充入0.2 mol的NH3,一段时间后反应再次达到平衡,恢复到150 ℃时测得此过程中从外界吸收了6.44 kJ的热量。
①充入NH3时,混合气体的密度将____________,在达到平衡的过程中,混合气体的密度将____________(填“增大”、“减小”或“不变”)。反应重新达平衡的混合气体对氢气的相对密度将____________5(填“>”、“<”或“=”)。
②下列哪些实验现象或数据能说明反应重新到达了平衡____________。
A.容器不再与外界发生热交换
B.混合气体的平均相对分子质量保持不变
C.当V(N2)?:V(H2):?V(NH3)=1:?3?:2时
D.当容器的体积不再发生变化时
③写出该反应的热化学方程式:__________________________________。
填空题 (12分)150 ℃时,向如图所示的容器(密封的隔板可自由滑动,整个过程中保持隔板上部压强不变)中加入4 L N2和H2的混合气体,在催化剂作用下充分反应(催化剂体积忽略不计),反应后恢复到原温度。平衡后容器体积变为3.4 L,容器内气体对相同条件的氢气的相对密度为5。

(1)反应前混合气体中V(N2)?:V(H2)=____________;反应达平衡后V(NH3)=____________L;该反应中N2转化率为____________。
(2)向平衡后的容器中充入0.2 mol的NH3,一段时间后反应再次达到平衡,恢复到150 ℃时测得此过程中从外界吸收了6.44 kJ的热量。
①充入NH3时,混合气体的密度将____________,在达到平衡的过程中,混合气体的密度将____________(填“增大”、“减小”或“不变”)。反应重新达平衡的混合气体对氢气的相对密度将____________5(填“>”、“<”或“=”)。
②下列哪些实验现象或数据能说明反应重新到达了平衡____________。
A.容器不再与外界发生热交换
B.混合气体的平均相对分子质量保持不变
C.当V(N2)?:V(H2):?V(NH3)=1:?3?:2时
D.当容器的体积不再发生变化时
③写出该反应的热化学方程式:__________________________________。
本题答案:(1)1︰3 0.6 30%????? (2)①增大 减小
本题解析:(1)设反应前混合气体中氮气的体积是x,则氢气是4-x。平衡后,气体体积减少了0.6L,所以根据反应式N2+3H2 2NH3可知,参加反应的氮气是0.3L,氢气是0.9L,生成氨气是0.6L。所以平衡时氮气是x-0.3,氢气是3.1-x。又因为容器内气体对相同条件的氢气的相对密度为5,所以有
2NH3可知,参加反应的氮气是0.3L,氢气是0.9L,生成氨气是0.6L。所以平衡时氮气是x-0.3,氢气是3.1-x。又因为容器内气体对相同条件的氢气的相对密度为5,所以有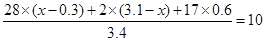 ,解得x=1L
,解得x=1L
所以氮气和氢气的体积之比是1︰3;反应中氮气的转化率是0.3÷1=0.3,即30%。
(2)①氨气的相对分子质量是17,所以混合气的平均相对分子质量增大,所以密度增大。氮气和氢气的体积是1︰3时,混合气的平均相对分子质量是 ,由于反应向逆反应方向进行,因此混合气的平均相对分子质量是减小,则密度也是减小的。但由于反应是压强不变的,因此平衡是等效的,即反应重新达平衡的混合气体对氢气的相对密度等于5来源:91 考试网。
,由于反应向逆反应方向进行,因此混合气的平均相对分子质量是减小,则密度也是减小的。但由于反应是压强不变的,因此平衡是等效的,即反应重新达平衡的混合气体对氢气的相对密度等于5来源:91 考试网。
②在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。所以A、B、D都是可以说明的。平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,所以选项C不正确,答案选ABD。
③由于平衡是等效的,所以氨气的转化率是70%,则消耗氨气是0.14mol,所以该反应的反应热是6.44kJ÷0.07molkJ·mol-1,所以该反应的热化学方程式是N2(g)+3H2(g) 2NH3(g) ΔH=-92 kJ·mol-1。
2NH3(g) ΔH=-92 kJ·mol-1。
本题所属考点:【反应速率与平衡的有关计算】
本题难易程度:【一般】
A birbe will enter without knocking. 贿赂毋须敲门而入。