微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
计算题 将2molN2和8mol H2在适宜条件下按下式进行反应:N2+3H2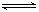 2NH3,当在某一温度下达到化学 平衡状态,若测得平衡混合气体对氢气的相对密度为4.19时,求N2的转化率?
2NH3,当在某一温度下达到化学 平衡状态,若测得平衡混合气体对氢气的相对密度为4.19时,求N2的转化率?
计算题 &nbs来源:91考试网p;将2molN2和8mol H2在适宜条件下按下式进行反应:N2+3H2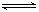 2NH3,当在某一温度下达到化学平衡状态,若测得平衡混合气体对氢气的相对密度为4.19时,求N2的转化率?
2NH3,当在某一温度下达到化学平衡状态,若测得平衡混合气体对氢气的相对密度为4.19时,求N2的转化率?
本题答案:35%
本题解析:考查可逆反应的有关计算,一般采用三段式。
N2+3H2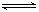 2NH3
2NH3
起始量(mol)??????? 2??? 8??????? 0
转化量(mol)??????? x??? 3x????? 2x
平衡量(mol)????? 2-x? 8-3x??? 2x
所以根据M=m/n可知
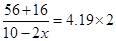
解得x=0.70
所以氮气的转化率是0.7÷2×100%=35%。
本题所属考点:【反应速率与平衡的有关计算】
本题难易程度:【一般】
It is no sin to sell dear,but a sin to give ill measure. 高价出售不为过,缺斤少两才是罪。