微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (17分)氨的合成原理为:N2(g)+3H2(g) 2NH3(g);△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图。
2NH3(g);△H= —92.4 KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如图。
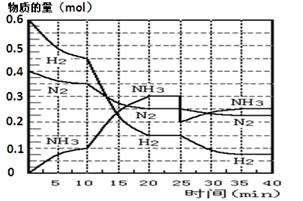
回答下列问题:
(1)10 min内以NH3表示的平均反应速率???????????????;
(2)在10 ~20 min内:NH3浓度变化的原因可能是??????????????????;
A.加了催化剂
B.缩小容器体积
C.降低温度
D.增加NH3物质的量
(3)第1次平衡的时间范围为:???? ?????????,第2次平衡的时间范围为:?????????????,
第1次平衡:平衡常数K1 = ???????????(带数据的表达式),第2次平衡时NH3的体积分数??????????;
(4)在反应进行至25 min时:
①曲线发生变化的原因:?????????????????
②达第二次平衡时,新平衡的平衡常数K2?????K1(填“大于”、“等于”、“小于”);
(5)在25~40 min时,计算合成氨过程中的反应热△H= ????????????????。
(6)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:
N2(g) + 3H2O(1) ?2NH3(g) +
?2NH3(g) +  O2(g)?;△H =" a" kJ·mol—1
O2(g)?;△H =" a" kJ·mol—1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如下表: