微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (12分)在一固定容积为2 L的密闭容器中加入2 molA和3 molB,保持温度为30℃,在催化剂存在的条件下进行下列反应:2A(g)+3B(g)  3C(g),2分钟达到平衡,生成1.5 mol C,此时,平衡混合气中C的体积分数为ω1;若将温度升高到70℃后,其他条件均不变,当反应重新达到平衡时,C的物质的量为2.1 mol,体积分数为ω2,请回答下列问题,
3C(g),2分钟达到平衡,生成1.5 mol C,此时,平衡混合气中C的体积分数为ω1;若将温度升高到70℃后,其他条件均不变,当反应重新达到平衡时,C的物质的量为2.1 mol,体积分数为ω2,请回答下列问题,
(1) 该反应在30℃时平衡常数K1=??????????,焓变△H??????0(填“>”、“<”或“=”)。
(2) 该反应在30℃时平衡混合气中C的体积分数为ω1=?????????;从反应开始到达到化学平衡状态时v(A)=____________mol/(L·min)
(3) 该反应在70℃时平衡常数为K2,则 K1??????K2(填“>”、“=”或“<”)
(4) 可以判断2A(g)+3B(g)  3C(g) 反应已经达到平衡的是( )
3C(g) 反应已经达到平衡的是( )
A.2v(B)=3v(A)????????????????????
B.密闭容器中总压强不变
C.n (A)∶n(B)∶n(C)=2∶3∶3???????
D.混合气体的平均相对分子质量不再改变
填空题 (12分)在一固定容积为2 L的密闭容器中加入2 molA和3 molB,保持温度为30℃,在催化剂存在的条件下进行下列反应:2A(g)+3B(g)  3C(g),2分钟达到平衡,生成1.5 mol C,此时,平衡混合气中C的体积分数为ω1;若将温度升高到70℃后,其他条件均不变,当反应重新达到平衡时,C的物质的量为2.1 mol,体积分数为ω2,请回答下列问题,
3C(g),2分钟达到平衡,生成1.5 mol C,此时,平衡混合气中C的体积分数为ω1;若将温度升高到70℃后,其他条件均不变,当反应重新达到平衡时,C的物质的量为2.1 mol,体积分数为ω2,请回答下列问题,
(1) 该反应在30℃时平衡常数K1=??????????,焓变△H??????0(填“>”、“<”或“=”)。
(2) 该反应在30℃时平衡混合气中C的体积分数为ω1=?????????;从反应开始到达到化学平衡状态时v(A)=____________mol/(L·min)
(3) 该反应在70℃时平衡常数为K2,则 K1??????K2(填“>”、“=”或“<”)
(4) 可以判断2A(g)+3B(g)  3C(g) 反应已经达到平衡的是( )
3C(g) 反应已经达到平衡的是( )
A.2v(B)=3v(A)????????????????????
B.密闭容器中总压强不变
C.n(A)∶n(B)∶n(C)=2∶3∶3???????
D.混合气体的平均相对分子质量不再改变
本题答案:(1)4?? >?(2)37.5%? 0.25??(3
本题解析:
试题分析:升高温度C的物质的量增加,说明升高温度平衡向正反应方向移动,因此正反应是吸热反应,即△H>0。
2A(g)+3B(g)  3C(g)
3C(g)
起始浓度(mol/L)???????? 1???? 1.5???????? 0
转化浓度(mol/L)???????? 0.5?? 0.75??????? 0.75
平衡浓度(mol/L)??????? 0.5??? 0.75??????? 0.75
(1)所以该反应在30℃时平衡常数K1=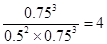
(2)该反应在3 91eXaM.org0℃时平衡混合气中C的体积分数为
ω1=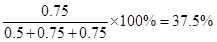 ;
;
从反应开始到达到化学平衡状态时v(A)=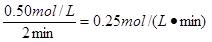
(3)正反应是吸热反应,升高温度平衡向正反应方向移动,所以平衡常数是增大的。
(4)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。速率之比是相应的化学计量数之比,因此A中的关系始终是成立,不正确。根据方程式可知,该反应是体积减小的可逆反应,所以压强也是减小的,因此当压强不再发生变化时,可以说明达到平衡状态,B正确;平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,因此选项C不正确;混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,所以D可以说明,因此答案选BD。
点评:可逆反应的有关计算一般采用三段式,而平衡状态的判断既要抓住本质正逆反应速率相等,又要抓住特征(例如浓度、含量等不再发生变化)。
本题所属考点:【反应速率与平衡的有关计算】
本题难易程度:【一般】
There is no time like the present. 最好的时间就是现在.