微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+ 2H2(g) CH3OH(g)
CH3OH(g)
根据题意完成下列各题:
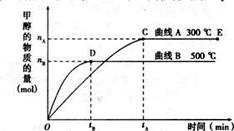
(1)5000C,从反应开始到平衡,甲醇的平均反应速率v(CH3OH)=???(用nB、 tB 表示)
(2)在其他条件不变的情况下,将处于E点的体系的体积压缩到原来的1/2,下列有关该体系的说法正确的是?????????????
a .氢气的浓度减少???????????????? b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加????????????? d.重新平衡时n(H2)/n(CH3OH)增大
(3)可逆反应:CO(g)+ 2H2(g) CH3OH(g) 在恒容密闭容器中反应,达到平衡状态的标志是:????
CH3OH(g) 在恒容密闭容器中反应,达到平衡状态的标志是:????
①单位时间内生成2n molH2的同时生成n mol CH3OH
②单位时间内生成2n molH2的同时,生成n mol CO
③用CO、H2、CH3OH 的物质的量浓度变化表示的反应速率的比为1 : 2 : 1的状态
④混 合气体的密度不再改变的状态
⑤ 混合气体的平均相对分子质量不再改变的状态
(4)改变下列哪些条件能增大甲醇的产量(??)
A.增大容器体积
B.增大压强
C.升高温度
D.加催化剂
(5)反应达到平衡后再升高温度,K值??????????(填“增大”“减小”或“不变”)。
(6)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:??????????????????????????????(用化学方程式表示)。
填空题 一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+ 2H2(g) CH3OH(g)
CH3OH(g)

根据题意完成下列各题:
(1)5000C,从反应开始到平衡,甲醇的平均反应速率v(CH3OH)=???(用nB、 tB 表示)
(2)在其他条件不变的情况下,将处于E点的体系的体积压缩到原来的1/2,下列有关该体系的说法正确的是?????????????
a .氢气的浓度减少???????????????? b.正反应速率加快,逆反应速率也加快
c.甲醇的物质的量增加????????????? d.重新平衡时n(H2)/n(CH3OH)增大
(3)可逆反应:CO(g)+ 2H2(g) CH3OH(g) 在恒容密闭容器中反应,达到平衡状态的标志是:????
CH3OH(g) 在恒容密闭容器中反应,达到平衡状态的标志是:????
①单位时间内生成2n molH2的同时生成n mol CH3OH
②单位时间内生成2n molH2的同时,生成n mol CO
③用CO、H2、CH3OH 的物质的量浓度变化表示的反应速率的比为1 : 2 : 1的状态
④混 合气体的密度不再改变的状态
⑤ 混合气体的平均相对分子质量不再改变的状态
(4)改变下列哪些条件能增大甲醇的产量(??)
A.增大容器体积
B.增大压强
C.升高温度
D.加催化剂
(5)反应达到平衡后再升高温度,K值??????????(填“增大”“减小”或“不变”)。
(6)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是:??????????????????????????????(用化学方程式表示)。
本题答案:(12分)(1)n(B)/[3t(B)]mol·l-1·mi
本题解析:
试题分析:(1)由图象可知,在500℃时,时间达到tB时,甲醇的物质的量为nB,所以甲醇的反应速率υ(CH3OH)=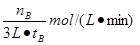 。
。
(2)在其他条件不变的情况 下,将处于E点的体系的体积压缩到原来的1/2,容器的体积减小,则压强增大,正逆反应速率都增大,平衡向正向移动,甲醇的物质的量增多,氢气的物质的量减小,但由于体积减小,平衡时氢气的浓度反而增大,所以答案选b、c。
(3)在一定条件下,当可逆反应的正反应速率和逆反应速率相等时(但不为0),反应体系中各种物质的浓度或含量不再发生变化的状态,称为化学平衡状态。①中反应速率的方向相反,且满足速率之比是相应的化学计量数之比,正确;②中反应速率的方向是相同的,速率之比是相应的化学计量数之比,因此②中的关系始终是成立,不正确;平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,③不正确;密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,④不正确;混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,所以⑤可以说明。答案选①、⑤。
(4)根据图像可知,温度越高,甲醇的物质的量越多,这说明正方应是放热反应,因此升高温度平衡向逆反应方向移动,降低甲醇的产量,C不正确;正方应是体积减小的,所以增大容器的容积降低压强,平衡向逆反应方向移动,降低甲醇的产量,A不正确,B正确;催化剂不能改变平衡状态,D不正确,答案选B。
(5)正方应是放热反应,因此升高温度平衡向逆反应方向移动,平衡常数减小。
(4)由于CO能还原氧化亚铜,即反应的方程式是Cu2O+CO 2Cu+CO2,所以反应体系中含少量CO2有利于向正反应方向移动。
2Cu+CO2,所以反应体系中含少量CO2有利于向正反应方向移动。
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生能力的培养和学习方法指导与训练。有助于培养学生的逻辑推理能力,提高学生的应试能力。该题的难点是平衡状态的判断。
本题所属考点:【反应速率与平衡的有关计算】
本题难易程度:【一般】
Progress is the activity of today and the assurance of tomorrow. 进步是今天的活动,明天的保证。