微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 830K时,在密闭容器中发生下列可逆反应:
CO(g)+H2O(g) ?CO2(g)+H2(g);△H<0??试回答下列问题:
?CO2(g)+H2(g);△H<0??试回答下列问题:
(1)若起始时c(CO)="2" mol?L-1,c(H2O)="3" mol?L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=???????????.
(2)在相同温度下,若起始时c(CO)="1" mol?L-1,c(H2O)="2" mo l?L-1,反应进行一段时间后,测得H2的浓度为0.5 mol?L-1,则此时该反应是否达到平衡状态 ???????(填“是”与“否”),?此时v(正)????????v(逆)(填“大于”“小于”或“等于”),你判断的依据是???????????
?????????????????????????????????????????????????????????。
(3)若降低温度,该反应的K值将??????????????(均填“增大”“减小”或“不变”)。
填空题 830K时,在密闭容器中发生下列可逆反应:
CO(g)+H2O(g) ?CO2(g)+H2(g);△H<0??试回答下列问题:
?CO2(g)+H2(g);△H<0??试回答下列问题:
(1)若起始时c(CO)="2" mol?L-1,c(H2O)="3" mol?L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=???????????.
(2)在相同温度下,若起始时c(CO)="1" mol?L-1,c(H2O)="2" mol?L-1,反应进行一段时间后,测得H2的浓度为0.5 mol?L-1,则此时该反应是否达到平衡状态 ???????(填“是”与“否”),?此时v(正)????????v(逆)(填“大于”“小于”或“等于”),你判断的依据是???????????
?????????????????????????????????????????????????????????。
(3)若降低温度,该反应的K值将??????????????(均填“增大”“减小”或“不变”)。
本题答案:(1)平衡常数k=1
(2)否??大于?依据是Q=0.
本题解析:
试题分析:(1)???? CO(g)+H2O(g) ?CO2(g)+H2(g)
?CO2(g)+H2(g)
起始浓度(mol/L)??? 2????? 3???????????? 0????? 0
之和浓度(mol/L)?? 1.2??? 1.2?????????? 1.2???? 1.2
平衡浓度(mol/L)?? 0.8??? 1.8?????????? 1.2???? 1.2
所以平衡常数K=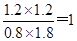
(2)在相同温度下,若起始时c(CO)="1" mol?L-1,c(H2O)="2" mol?L-1,反应进行一段时间后,测得H2的浓度为0.5 mol?L-1,则根据方程式可知,此时CO2的浓度也是0.5mol/L,而CO和水蒸气的浓度分别是0.5mol/L和1.5mol/L,则此时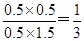 <1,所以反应没有达到平衡状态。此时正反应速率大于逆反应速率。
<1,所以反应没有达到平衡状态。此时正反应速率大于逆反应速率。
(3)正反应是放热反应,则降低温度,平衡向正反应方向进行,所以该反应的K值将增大。
点评:该题是高考中的常见题型和重要的考点,属于中等难度的试题。试题贴近高考,基础性强,侧重对学生灵活运用基础知识解决实际问题的能力的培养。该题的关键是明确平衡常数的含义、计算依据以及影响因素,如何结合题意灵活运用即可。有利于调动学生的学习兴趣,提高学生的应试能力。
本题所属考点:【反应速率与平衡的有关计算】
本题难易程度:【一般】
The best fish swim near the bottom. 高山出鹰鹞,深水藏好鱼.