微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (1)将一定量纯净的氨基甲酸铵置于密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
H2NCOONH4(s) 2NH3(g)+CO2(g)
2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
温度(℃)
| 15.0
| 20.0
| 25.0
| 30.0
| 35.0
|
平衡气体总浓度(×10—3 mol/L)
| 2.4
| 3.4
| 4.8
| 6.8
| 9.4
?
①氨基甲酸 铵分解反应的焓变△H ?????????0(填“>”、“<”或“=”)。
②可以判断该分解反应已经达到化学平衡的是____。
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
③根据表中数据,计算25.0℃时的分解平衡常数为?????????????。
(2)25℃时,NH3.H2O电离常数Kb=1.8×10—5,Mg(OH)2的溶度积常数Ksp=1.8×10—11,用pH计测得0.5 mol/L氨水溶液的pH约为???。在某氯化镁溶液中加入一定量的某浓度的烧碱后,测得混合液pH =11.0,则此温度下残留在溶液中的c(Mg2+)=____。(已知lg2≈0.3、lg3≈0.5)。
填空题 (1)将一定量纯净的氨基甲酸铵置于密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
H2NCOONH4(s) 2NH3(g)+CO2(g) 2NH3(g)+CO2(g)
实验测得不同温度下的平衡数据列于下表:
温度(℃)
| 15.0
| 20.0
| 25.0
| 30.0
| 35.0
| 平衡气体总浓度(×10—3 mol/L)
| 2.4
| 3.4
| 4.8
| 6.8
| 9.4
?
①氨基甲酸铵分解反应的焓变△H ?????????0(填“>”、“<”或“=”)。
②可以判断该分解反应已经达到化学平衡的是____。
A.2v(NH3)=v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
③根据表中数据,计算25.0℃时的分解平衡常数为?????????????。
(2)25℃时,NH3.H2O电离常数Kb=1.8×10—5,Mg(OH)2的溶度积常数Ksp=1.8×10—11,用pH计测得0.5 mol/L氨水溶液的pH约为???。在某氯化镁溶液中加入一定量的某浓度的烧碱后,测得混合液pH =11.0,则此温度下残留在溶液中的c(Mg2+)=____。(已知lg2≈0.3、lg3≈0.5)。
本题答案:⑴?①>?(1分)②Bc(2分)③1.64×10-8m
本题解析:⑴①由表中数据可知:温度升高,平衡时气体总浓度变大,即平衡正向移动,正向是吸热反应,△H?>0,答案:>?;②A不正确,不能确定正逆反速率是否相等,可以是v(NH3)消耗=2v(CO2)生成;B、正确,只要平衡发生移动,压强就发生变化;C、正确,反应前后的气体质量发生变化;D、不正确,不管平衡是否移动,NH3的体积分数总是占2/3.③平衡时,NH3和CO2的浓度分别为4.8×10—3 mol/L×2/3=3.2×10—3 mol/L,4.8×10—3 mol/L×1/3=1.6×10—3 mol/L,K=??(3.2×10—3 mol/L)2×1.6×10—3 mol/L=1.64×10-8mol3/L3?,答案:1.64×10-8mol3/L3?。
⑵NH3.H2O NH4++OH― ,Kb=1.8×10—5=?c(NH4+)c(OH― )/c(NH3·H2O)=c2(OH― )/c(NH3·H2O),得:c(OH― )= NH4++OH― ,Kb=1.8×10—5=?c(NH4+)c(OH― )/c(NH3·H2O)=c2(OH― )/c(NH3·H2O),得:c(OH― )=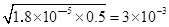 ,?pH=14+lg3×10-3=14-3+lg3=11.5;PH=11时,c(OH― )=10-3mol/L,c(Mg2+)=Ksp/c2(OH― )=1.8×10—11/(10-3)2=1.8×10-5mol/L。答案:1.8×10-5mol/L。 ,?pH=14+lg3×10-3=14-3+lg3=11.5;PH=11时,c(OH― )=10-3mol/L,c(Mg2+)=Ksp/c2(OH― )=1.8×10—11/(10-3)2=1.8×10-5mol/L。答案:1.8×10-5mol/L。
考点:化学平衡及其在电解质溶液中的应用
本题所属考点:【反应速率与平衡的有关计算】
本题难易程度:【一般】
Bread is the staff of life. 民以食为天。 |
|