微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上合成甲醇的反应为:CO(g)+2 H2(g) CH3OH(g);ΔH
CH3OH(g);ΔH
(1)已知,该反应在300℃,5MPa条件下能自发进行,则ΔH?????0,△S????0(填“<,>或=”)。
(2)在300℃,5MPa条件下,将0.20mol的 CO与0.58mol H2的混合气体充入2L密闭容器发生反应,反应过程中甲醇的物质的量浓度随时间的变化如图所示。
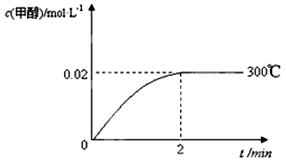
①在0~2min内,以H2表示的平均反应速率为?????????mol·L-1·s-1 ,CO的转化率为????????。
②列式计算300℃时该反应的平衡常数K=??????????????????????????????????。
③300℃时,将0.50mol CO、1.00mol H2和1.00 mol CH3OH充入容积为2L的密闭容器中,此时反应将??????????。
A.向正方向移动?? B.向逆方向移动?? C.处于平衡状态?? D.无法判断
④下列措施可增加甲醇产率的是???????????。
A.压缩容器体积??????????????? B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大?? D.再充入0.20mol CO和0.58mol H2
(3)若其它条件不变,使反应在500℃下进行,在图中作出甲醇的物质的量浓度随时间的变化的示意图。
填空题 能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。工业上合成甲醇的反应为:CO(g)+2H2(g) CH3OH(g);ΔH
CH3OH(g);ΔH
(1)已知,该反应在300℃,5MPa条件下能自发进行,则ΔH?????0,△S????0(填“<,>或=”)。
(2)在300℃,5MPa条件下,将0.20mol的 CO与0.58mol H2的混合气体充入2L密闭容器发生反应,反应过程中甲醇的物质的量浓度随时间的变化如图所示。

①在0~2min内,以H2表示的平均反应速率为?????????mol·L-1·s-1 ,CO的转化率为????????。
②列式计算300℃时该反应的平衡常数K=??????????????????????????????????。
③300℃时,将0.50mol CO、1.00mol H2和1.00 mol CH3OH充入容积为2L的密闭容器中,此时反应将??????????。
A.向正方向移动?? B.向逆方向移动?? C.处于平衡状态?? D.无法判断
④下列措施可增加甲醇产率的是???????????。
A.压缩容器体积??????????????? B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大?? D.再充入0.20mol CO和0.58mol H2
(3)若其它条件不变,使反应在500℃下进行,在图中作出甲醇的物质的量浓度随时间的变化的示意图。
本题答案:(1)< <(各1分)(2)①0.02? 20%(各2分)
本题解析:
试题分析:(1)根据△G=△H-T·△S可知,只要△G小于0,反应就是自发的。反应CO(g)+2H2(g) CH3OH(g)是熵值减小的可逆反应,所以根据该反应CO(g)+2H2(g)
CH3OH(g)是熵值减小的可逆反应,所以根据该反应CO(g)+2H2(g) CH3OH(g)在300℃,5MPa条件下能自发进行可知,该反应的ΔH<0,△S<0。
CH3OH(g)在300℃,5MPa条件下能自发进行可知,该反应的ΔH<0,△S<0。
(2)①根据图像可知,反应进行到2min时达到平衡状态,此时甲醇的浓度是0.02mol/L,则根据方程式可知消耗氢气的浓度是0.04mol/L,所以在0~2min内,以H2表示的平均反应速率为0.04mol/L÷2min=0.02mol/(L1min)。又因为消耗CO的物质的量浓度是0.02mol/L,而CO的起始浓度=0.2mol/L=2L=0.1mol/L,所以CO的转化率= ×100%=20%。
×100%=20%。
②根据①中分析可知,平衡时氢气和CO的浓度 91ExAm.org分别是0.58mol÷2L-0.04mol/L=0.25mol/L,0.1mol/L-0.02mol/L=0.08mol/L,而甲醇的平衡浓度是0.02mol/L。由于化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以该温度下反应的平衡常数K=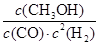 =
= =4。
=4。
②300℃时,将0.50mol CO、1.00mol H2和1.00 mol CH3OH充入容积为2L的密闭容器中,此时浓度商=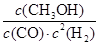 =
=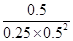 =8>4,所以反应向逆反应方向移动,答案选B。
=8>4,所以反应向逆反应方向移动,答案选B。
④该反应是体积减小的放热的可逆反应,则A、压缩容器体积压强增大,平衡向正反应方向移动,甲醇的产率增大,A正确;B、将CH3OH(g)从体系中分离,平衡向正反应方向移动,甲醇产率增大,B正确;C.充入He,使体系总压强增大,平衡不移动,甲醇产率不变,C不正确;D.再充入0.20mol CO和0.58mol H2,平衡向正反应方向移动,甲醇的产率增大,D正确,答案选ABD。
(3)由于该反应是放热反应,所以若其它条件不变,使反应在500℃下进行,反应速率增大,达到平衡的时间减少,但不利于平衡向正反应方向移动,因此甲醇的浓度降低,所以甲醇的物质的量浓度随时间的变化的示意图为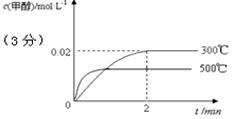 。
。
本题所属考点:【反应速率与平衡的有关计算】
本题难易程度:【一般】
A love that could die was not real love. 真正的爱情不会死亡.