微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g) 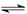 2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
(1)①该反应的化学平衡常数表达式为K=???????。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越???????。
(2)某温度下,若把10 mol N2与30 mol H2置于体积为10 L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的K=???????(可用分数表示)。能说明该反应达 到化学平衡状态的是???????(填字母)。
a.容器内的密度保持不变
b.容器内压强保持不变
c.v正(N2)=2v逆(NH3)
d.混合气体中c(NH3)不变
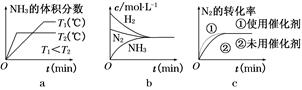
(3)对于合成氨反应而言,下列有关图像一定正确的是(选填序号)???????。
填空题 合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g) 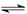 2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
2NH3(g) ΔH=-92.4 kJ/mol,据此回答以下问题:
(1)①该反应的化学平衡常数表达式为K=???????。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越???????。
(2)某温度下,若把10 mol N2与30 mol H来源:91考试网 91ExaM.org2置于体积为10 L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则该温度下反应的K=???????(可用分数表示)。能说明该反应达到化学平衡状态的是???????(填字母)。
a.容器内的密度保持不变
b.容器内压强保持不变
c.v正(N2)=2v逆(NH3)
d.混合气体中c(NH3)不变
(3)对于合成氨反应而言,下列有关图像一定正确的是(选填序号)???????。

本题答案:(1)①+3H2(g) <img onload='if(this.width>600)makesmallpic(this,600,1800);' src=) 2NH3(g)ΔH=-92.4 kJ/mol,
2NH3(g)ΔH=-92.4 kJ/mol,
是一个气体体积减小的放热反应。
(1)①由方程式知K=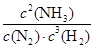 。
。
②升高温度,平衡向吸热反应方向移动,即向逆反应方向移动,c(NH3)减小,c(N2)、c(H2)增大,故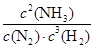 减小,K值减小。
减小,K值减小。
(2)设N2转化了x mol·L-1则
N2(g)+H2(g) 2NH3(g)
2NH3(g)
开始时:(mol·L-1)? 1? 3? 0
转化:(mol·L-1)? x? 3x? 2x
平衡时:(mol·L-1)? 1-x? 3-3x? 2x
则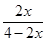 =20%,x=
=20%,x=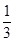 ;
;
K=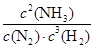 =
=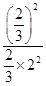 =
=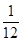 。
。
判断平衡状态的标志是①v(正)=v(逆),②各成分的浓度保持不变。ρ=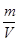 始终不变,a不能说明是否达平衡状态,
始终不变,a不能说明是否达平衡状态,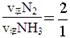 ,c不能说明反应达平衡状态。
,c不能说明反应达平衡状态。
(3)温度越高,反应越快,达平衡所用时间越短。T1<T2,由T1→T2升高温度,平衡向逆反应方向移动,NH3的体积分数减小,a正确;达平衡时c(N2)、c(H2)、c(NH3)不变,不是c(N2)=c(NH3)=c(H2),b错误;使用催化剂,加快反应速率,但平衡不移动,c正确。
本题所属考点:【反应速率与平衡的有关计算】
本题难易程度:【一般】
He who is first come is first served. 先到的先得。