微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
选择题 在一体积为10 L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
CO(g)+H2O(g)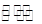 CO2(g)+H2(g)??△H<0。
CO2(g)+H2(g)??△H<0。
(1)CO和H2O浓度变化如图,则在该温度下,该反应的平衡常数K=???????。
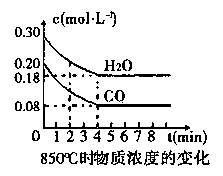
0~4 min的平均反应速率v(CO)=???mol·L-1·min-1。若降低温度,该反应的K值将??????,该反应的化学 反应速率将?????(填“增大”“减小”或“不变”)。
(2)在相同容器中发生上述反应,当温度高于850℃时,容器内各物质的浓度变化如下表。
时间(min)
| CO
| H2O
| CO2
| H2
|
0
| 0.200
| 0.300
| 0
| 0
|
2
| 0.138
| 0.238
| 0.062
| 0.062
|
3
| c1
| c2
| c3
| c3
|
4
| c1
| c2
| c3
| c3
|
5
| 0.116
| 0.216
| 0.084
| ?
|
6
| 0.096
| 0.266
| 0.104
| ?
?
①表中3 min~4 min之间反应处于???????状态;cl数值???0.08? mol·L-1(填大于、小于或等于)。
②反应在4 min~5 min之间,平衡向逆方向移动,可能的原因是
a.增加水蒸气??? b.降低温度???? c.使用催化剂??? d.增加氢气浓度
(3)在相同温度下(850℃),若起始时c(CO)=1mol·L-1,C(H2O)=2mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态???????(填“是”与“否”),此时v(正)???????v(逆)(填“大于”“小于”或“等于”),你判断的依据是????????。
选择题 在一体积为10 L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
CO(g)+H2O(g)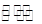 CO2(g)+H2(g)??△H<0。 CO2(g)+H2(g)??△H<0。
(1)CO和H2O浓度变化如图,则在该温度下,该反应的平衡常数K=???????。

0~4 min的平均反应速率v(CO)=???mol·L-1·min-1。若降低温度,该反应的K值将??????,该反应的化学反应速率将?????(填“增大”“减小”或“不变”)。
(2)在相同容器中发生上述反应,当温度高于850℃时,容器内各物质的浓度变化如下表。
时间(min)
| CO
| H2O
| CO2
| H2
| 0
| 0.200
| 0.300
| 0
| 0
| 2
| 0.138
| 0.238
| 0.062
| 0.062
| 3
| c1
| c2
| c3
| c3
| 4
| c1
| c2
| c3
| c3
| 5
| 0.116
| 0.216
| 0.084
| ?
| 6
| 0.096
| 0.266
| 0.104
| ?
?
①表中3 min~4 min之间反应处于???????状态;cl数值???0.08? mol·L-1(填大于、小于或等于)。
②反应在4 min~5 min之间,平衡向逆方向移动,可能的原因是
a.增加水蒸气??? b.降低温度???? c.使用催化剂??? d.增加氢气浓度
(3)在相同温度下(850℃),若起始时c(CO)=1mol·L-1,C(H2O)=2mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态???????(填“是”与“否”),此时v(正)???????v(逆)(填“大于”“小于”或“等于”),你判断的依据是????????。
本题答案:(1)1????????0.03?????增大?????减小
本题解析:
试题分析:(1)由图可以知道CO和H2O浓度在达到平衡时的浓度分别为0.08 mol/L、0.18mol/L,反应生成的CO2、H2都为0.12mol/L,则在该温度下,该反应的平衡常数K=0.12×0.12/(0.08×0.18)=1;0~4min的平均反应速率v(CO)=(0.20-0.08)/4=0.03mol·L-1·min-1,△H<0,说明该反应为放热反应,所以降低温度,该反应的K值将增大,温度降低,化学反应速率减小;
(2)因为3min~4min各物质的浓度相等,所以3min~4min之间反应处于平衡状态,c 1数值大于0.08 mol·L-1,因为前两分钟的C O化学反应速率为(0.200-0.138)/2=0.031mol·L-1·min-1,根据一个反应浓度减少,化学反应速率也减少,若c 1数值的数值为0.08 mol·L-1,则其在2-3min的平均化学速率为(0.138-0.08)/1=0.058mol·L-1·min-1,这种情况是不可能发生的,所以c 1数值大于0.08 mol·L-1;
②反应在4min~5min间,平衡向逆方向移动,可能的原因是为增加氢气浓度,因为产物的浓度均增大,而反应物之一的CO的浓度减少,所以增加氢气浓度,故本题的答案选择d;
(3)在相同温度下(850℃),平衡常数为1,因为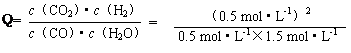 = =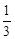 <K=1,所以该反应未达到化学平衡,此时v(正)>v(逆),反应向右进行。 <K=1,所以该反应未达到化学平衡,此时v(正)>v(逆),反应向右进行。
本题所属考点:【反应速率与平衡的有关计算】
本题难易程度:【一般】
Youth is a blunder; manhood a struggle; old age a regret. 青年鲁莽灭裂,中年奋斗不止;老年后悔无穷. |
|