|
水煤气是一种高效气体燃料,其主要成分是CO和H2,可用水蒸气通过炽【反应速率与平衡的有关计算】
2017-01-04 20:36:26
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 水煤气是一种高效气体燃料,其主要成分是CO和H2,可用水蒸气通过炽热的碳制得:C (s)+H2O(g) CO (g)+H2 (g) ΔH="+131" kJ·mol-1 CO (g)+H2 (g) ΔH="+131" kJ·mol-1
(1)T温度下,四个容器中均进行着上述反应,各容器中碳足量,其他 物质的物质的量浓度及正、逆反应速率关系如下表所示。请填写表中相应的空格。
容器
编号
| c(H2O)
/mol·L-1
| c(CO)
/mol·L-1
| c(H2)
/mol·L-1
| v正、v逆比较
| Ⅰ
| 0.06
| 0.60
| 0.10
| v正=v逆
| Ⅱ
| 0.06
| 0.50
| 0.40
| ①
| Ⅲ
| 0.12
| 0.40
| 0.80
| v正<v逆
| Ⅳ
| 0.12
| 0.30
| ②
| v正=v逆
?
① ,② ??????????????????????????。?
在T温度下该反应的化学平衡常数为 ? 。?
(2)另有一个容积可变的密闭容器。恒温恒压下,向其中加入1.0 mol碳和1.0 mol水蒸气 (H2O),发生上述反应,达到平衡时,容器的体积变为原来的1.25 倍。平衡时水蒸气的转化率为 ;向该容器中补充a mol 碳,水蒸气的转化率将 (填 “增大”、“减小”或“不变”)。?
(3)在一定条件下用水煤气能合成甲醇:CO(g)+2H2(g)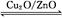 CH3OH(g) ΔH>0,给合成甲醇反应体系中通入少量CO则平衡 移动,减小压强则平衡 移动,降低温度则平衡 移动(填“向左”、“向右”或“不”)。? CH3OH(g) ΔH>0,给合成甲醇反应体系中通入少量CO则平衡 移动,减小压强则平衡 移动,降低温度则平衡 移动(填“向左”、“向右”或“不”)。?
填空题 水煤气是一种高效气体燃料,其主要成分是CO和H2,可用水蒸气通过炽热的碳制得:C (s)+H2O(g) CO (g)+H2 (g) ΔH="+131" kJ·mol-1 CO (g)+H2 (g) ΔH="+131" kJ·mol-1
(1)T温度下,四个容器中均进行着上述反应,各容器中碳足量,其他物质的物质的量浓度及正、逆反应速率关系如下表所示。请填写表中相应的空格。
容器
编号
| c(H2O)
/mol·L-1
| c(CO)
/mol·L-1
| c(H2)
/mol·L-1
| v正、v逆比较
| Ⅰ
| 0.06
| 0.60
| 0.10
| v正=v逆
| Ⅱ
| 0.06
| 0.50
| 0.40
| ①
| Ⅲ
| 0.12
| 0.40
| 0.80
| v正<v逆
| Ⅳ
| 0.12
| 0.30
| ②
| v正=v逆
?
① ,② ??????????????????????????。?
在T温度下该反应的化学平衡常数为 ? 。?
(2)另有一个容积可变的密闭容器。恒温恒压下,向其中加入1.0 mol碳和1.0 mol水蒸气 (H2O) ,发生上述反应,达到平衡时,容器的体积变为原来的1.25 倍。平衡时水蒸气的转化率为 ;向该容器中补充a mol 碳,水蒸气的转化率将 (填 “增大”、“减小”或“不变”)。?
(3)在一定条件下用水煤气能合成甲醇:CO(g)+2H2(g)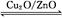 CH3OH(g) ΔH>0,给合成甲醇反应体系中通入少量CO则平衡 移动,减小压强则平衡 移动,降低温度则平衡 移动(填“向左”、“向右”或“不”)。? CH3OH(g) ΔH>0,给合成甲醇反应体系中通入少量CO则平衡 移动,减小压强则平衡 移动,降低温度则平衡 移动(填“向左”、“向右”或“不”)。?
本题答案:(1)①v正<v逆 ②0.40 1.00
(2)
本题解析:(1)根据Ⅰ可知,K=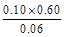 =1.00,Ⅱ中Q= =1.00,Ⅱ中Q=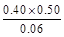 = =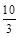 >K,所以反应向逆反应方向移动,即正反应速率小于逆反应速率。在Ⅳ中反应处于平衡状态,设c(H2)="a" mol·L-1,则 >K,所以反应向逆反应方向移动,即正反应速率小于逆反应速率。在Ⅳ中反应处于平衡状态,设c(H2)="a" mol·L-1,则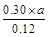 =1.00,解得a=0.40。 =1.00,解得a=0.40。
(2) C(s)+H2O(g) CO(g)+H2(g) CO(g)+H2(g)
起始量(mol) ??? 1.0
转化量(mol) ??? x???????? x??? x
平衡量(mol) ??? 1.0-x????? x????????? x
所以有1.0-x+x+x=1.25×1.0
解得x=0.25
所以转化率是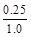 ×100%=25% ×100%=25%
碳是固体,所以增加碳的质量,平衡不移动,水蒸气的转化率不变。
(3)增加CO的浓度,平衡向正反应方向移动。因为反应是体积减小的、吸热的可逆反应,所以降低压强或降低温度平衡都向逆反应方向移动。
本题所属考点:【反应速率与平衡的有关计算】
本题难易程度:【一般】
Through obedience learn to command. 通过服从学习指挥. |
|
|
网站客服QQ: 960335752 - 14613519 - 791315772
|