微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (14分)已知CO2、SO2、NOx是对环境影响较大的气体,请你运用所学知识参与环境治理,使我们周围的空气更好。
(1)硫酸生产中,SO2催化氧化生成SO3,反应混合体系
中SO3的百分含量和温度的关系如右图所示(曲线上
点均为平衡状态)。由图可知:
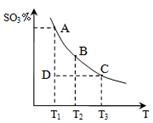
①2SO2(g) + O2(g) 2SO3(g)的△H____0(填“>”或“<”),若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡?????????????移动(填“向左”、“向右”或“不移动”);
2SO3(g)的△H____0(填“>”或“<”),若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡?????????????移动(填“向左”、“向右”或“不移动”);
②若温度为T1时,反应进行到状态D时,v(正)_______v(逆)(填“>”、 “<”或“=”);
③硫酸厂的SO2尾气用过量的氨水吸收,对SO2可进行回收及重新利用,反应的化学方程式为???????????????????????????????、???????????????????????????????????;
④新型氨法烟气脱硫技术是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。其优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为:________(只要求写一种);
(2)汽车尾气(含有烃类、CO、NOx等物质)是城市空气的污染源。治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。其前半部反应方程式为:
2CO+2NO  2CO2+N2。它的优点是???????????????????????????????????;
2CO2+N2。它的优点是???????????????????????????????????;
(3)有人设想用图所示装置,运用电化学原理将CO2、SO2转
化为重要化工原料。

①若A为CO2,B为H2,C为CH3OH,则正极电极反应式为
???????????????????????????????;
②若A为SO2,B为O2,C为H2SO4。科研人员希望每分钟
从C处获得100 mL 10 mol/L H2SO4,则A处通入烟气(SO2
的体积分数为1%)的速率为?????????????????????L/min(标准状况)。
填空题 (14分)已知CO2、SO2、NOx是对环境影响较大的气体,请你运用所学知识参与环境治理,使我们周围的空气更好。
(1)硫酸生产中,SO2催化氧化生成SO3,反应混合体系
中SO3的百分含量和温度的关系如右图所示(曲线上
点均为平衡状态)。由图可知:

①2SO2(g) + O2(g) 2SO3(g)的△H____0(填“>”或“<”),若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡?????????????移动(填“向左”、“向右”或“不移动”);
2SO3(g)的△H____0(填“>”或“<”),若在恒温、恒压条件下向上述平衡体系中通入氦气,平衡?????????????移动(填“向左”、“向右”或“不移动”);
②若温度为T1时,反应进行到状态D时,v(正)_______v(逆)(填“>”、“<”或“=”);
③硫酸厂的SO2尾气用过量的氨水吸收,对SO2可进行回收及重新利用,反应的化学方程式为???????????????????????????????、???????????????????????????????????;
④新型氨法烟气脱硫技术是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。其优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为:________(只要求写一种);
(2)汽车尾气(含有烃类、CO、NOx等物质)是城市空气的污染源。治理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂)。其前半部反应方程式为:
2CO+2NO  2CO2+N2。它的优点是???????????????????????????????????;
2CO2+N2。它的优点是???????????????????????????????????;
(3)有人设想用图所示装置,运用电化学原理将CO2、SO2转
化为重要化工原料。

①若A为CO2,B为H2,C为CH3OH,则正极电极反应式为
???????????????????????????????;
②若A为SO2,B为O2,C为H2SO4。科研人员希望每分钟
从C处获得100 mL 10 mol/L H2SO4,则A处通入烟气(SO2
的体积分数为1%)的速率为?????????????????????L/min(标准状况)。
本题答案:(14分)
(1)① < ;(1分)?向左;(1分)?
本题解析:
试题分析:(1)①根据图可判断随温度升高,三氧化硫的百分含量减小,说明升温平衡逆向移动,所以正向是放热反应,△H<0;在恒温、恒压条件下向上述平衡体系中通入氦气,使容器体积增大,各物质浓度均减小,相当于体系减小压强,平衡向左移动;
②若温度为T1时,反应进行到状态D时,三氧化硫的转化率未达平衡状态的转化率,所以反应正向进行,v(正)>v(逆);
③SO2尾气用过量的氨水吸收,先生成亚硫酸铵,再与硫酸反应又生成二氧化硫,化学方程式为SO2+H2O+2NH3 =(NH4)2SO3 、(NH4)2SO3+H2SO4 =(NH4)2SO4+SO2↑+H2O ;
(2)它的优点是使有毒气体转化为无毒气体;
(3)①若A为CO2,B为H2,C为CH3OH,则正极发生还原反应,元素化合价降低,所以是CO2发生还原反应生成甲醇,电极反应式为CO2+6H++6e-= CH3OH+H2O;
②A为SO2,则SO2+2H2O-2e-=H2SO 4+2H+,每分钟从C处获得1mol H2SO4,则需要二氧化硫是22.4L(标准状况),SO2的体积分数为1%,所以A处通入烟气的速率是22.4L/min÷1%=2240L/min。
本题所属考点:【反应速率与平衡的有关计算】
本题难易程度:【一般】
A poor spirit is poorer than a poor purse. 精神空虚比钱包空虚更可怜.