微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
计算题 (14分)为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要。
(1)汽车内燃机工作时会引起N2和O2的反应:N2 + O2 2NO,是导致汽车尾气中含有NO的原因之一。
2NO,是导致汽车尾气中含有NO的原因之一。
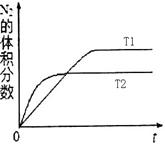
①在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如右图所示,根据图像判断反应N2(g) + O2(g) 2NO(g)的△H________0(填“>”或“<”)。
2NO(g)的△H________0(填“>”或“<”)。
②在T3温度下,向2L密闭容器中充入10molN2与5mo1O2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率υ(N2)=___________________。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为____________。
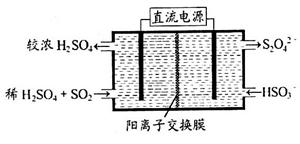
(2)利用右图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。
①阳极的电极反应式为_____________________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应中氧化剂与还原剂的物质的量之比为________。
(3)一定条件下可用甲醇与CO反应生成醋酸消除CO污染。常温下,将a mol/L的醋酸与b mol/L
Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=____________________ 91ExAm.org__(用含a和b的代数式表示)。
(4)引起雾霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3、有机颗粒物及扬尘等,任写一种与SO42-互为等电子体的分子?????????????????。
计算题 (14分)为有效控制雾霾,各地积极采取措施改善大气质量,研究并有效控制空气中的氮氧化物、碳氧化物和硫氧化物含量显得尤为重要。
(1)汽车内燃机工作时会引起N2和O2的反应:N2 + O2 2NO,是导致汽车尾气中含有NO的原因之一。
2NO,是导致汽车尾气中含有NO的原因之一。
①在T1、T2温度下,一定量的NO发生分解反应时N2的体积分数随时间变化如右图所示,根据图像判断反应N2(g) + O2(g) 2NO(g)的△H________0(填“>”或“<”)。
2NO(g)的△H________0(填“>”或“<”)。
②在T3温度下,向2L密闭容器中充入10mo lN2与5mo1O2,50秒后达到平衡,测得NO的物质的量为2mol,则该反应的速率υ(N2)=___________________。该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则达到平衡后N2的转化率为____________。


(2)利用右图所示装置(电极均为惰性电极)可吸收SO2,用阴极排出的溶液可吸收NO2。
①阳极的电极反应式为_____________________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应中氧化剂与还原剂的物质的量之比为________。
(3)一定条件下可用甲醇与CO反应生成醋酸消除CO污染。常温下,将a mol/L的醋酸与b mol/L
Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=______________________(用含a和b的代数式表示)。
(4)引起雾霾的PM2.5微细粒子包含(NH4)2SO4、NH4NO3、有机颗粒物及扬尘等,任写一种与SO42-互为等电子体的分子?????????????????。
本题答案:(1)① >?②0.01 mol·L-1·s-1;14.3%
本题解析:
试题分析:(1)①温度为T2时首先达到平衡状态,说明温度是T1<T2,但温度高氮气的体积分数降低,这说明升高温度平衡向正反应方向进行,因此正方应是吸热反应,即△H>0。
②50秒后达到平衡,测得NO的物质的量为2mol,则根据反应的化学方程式可知消耗氮气的物质的量是1mol,其浓度是0.5mol/L,所以该反应的速率υ(N2)=0.5mol/L÷50s=0.01 mol·L-1·s-1;平衡时氮气和氧气的浓度分别是5mol/L-0.5mol/L=4.5mol/L、2.5mol/L-0.5mol/L=2mol/L,NO的浓度是1mol/L,所以该温度下平衡常数K=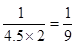 ,如果该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则N2(g) + O2(g)
,如果该温度下,若开始时向上述容器中充入N2与O2均为1 mol,则N2(g) + O2(g) 2NO(g)
2NO(g)
起始浓度(mol/L)0.5??????? 0.5????????? 0
转化浓度(mol/L) x????????? x?????????? 2x
平衡浓度(mol/L)0.5-x??? 0.5-x??????? 2x
则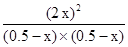 ?=
?=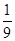 ?
?
解得x= ?
?
因此达到平衡后N2的转化率为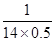 ?×100%=14.35
?×100%=14.35
(2)①电解池中阳极极失去电子,发生氧化反应,所以SO2在阳极通入,被氧化生成硫酸,电极反应式是SO2+2H2O-2e-=4H++SO42-。
②阴极排除的是S2O42-在与NO2的反应中S元素化合价从+3价升高到+4价,失去1个电子,则1molS2O42-失去2mol电子。NO2转化为无毒的气体应该是氮气,反应中氮元素化合价从+4价降低到0价,得到4个电子,因此根据电子得失守恒可知氧化剂与还原剂的物质的量之比为1:2。
(3)根据电荷守恒可知2c(Ba2+)+c(H+)=c(CH3COO-)+c(OH-),因此根据2c(Ba2+)=c(CH3COO-)可知,溶液中c(H+)=c(OH-)。根据原子守恒可知2c(Ba2+)=c(CH3COO-)=bmol/L,因此溶液中醋酸分子的浓度是0.5amol/L-bmol/L,则醋酸溶液的电离常数Ka= ?=
?= ×10-7 mol·L-1。
×10-7 mol·L-1。
(4)价电子数和原子数分别都相等的是等电子体,硫酸根中含有5个原子,32个价电子,因此与SO42-互为等电子体的分子有CCl4或CF4等。
本题所属考点:【反应速率与平衡的有关计算】
本题难易程度:【一般】
No man is content with his lot. 没有人对自己的境遇感到满足.