微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题&nbs p; (15分)含铬污水处理是污染治理的重要课题。污水中铬元素以Cr2O72-和CrO42-形式存在,常见除铬基本步骤是:

(1)加酸可以使CrO42-转化为Cr2O72-:?2CrO42- + 2H+ ?Cr2O72- + H2O
?Cr2O72- + H2O
若常温下pH=1溶液中Cr2O72-浓度为0.1 mol?L-1,Cr2O72-浓度是CrO42-浓度的10倍,该化学平衡常数K=??????。
(2)六价铬的毒性大约是三价铬的100倍,二氧化硫还原法是在酸性溶液中通SO2将Cr2O72-还原,反应的离子方程式为?????????????????????????????????。而后再加碱将Cr3+沉淀,已知常温下Ksp[Cr(OH)3] =10-32,要使c(Cr3+)降低到10-5mol?L-1,溶液的pH应升高到????。
(3)电解还原法是利用电解产生的Fe2+将Cr2O72-还原为Cr3+.电解装置所用的电极材料是碳棒和铁片,其中铁片连接直流电源的??????极。
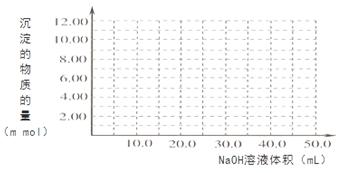
(4)Cr(OH)3为绿色粘性沉淀,类似于Al(OH)3既溶于酸又能溶于强碱溶液。Cr(OH)3溶于稀硫酸的化学方程式为????????????????????????????????????????????????????。往100.00mL 0.1000 mol?L-1CrCl3溶液滴加1.000mol?L-1NaOH溶液, 请画出生成沉淀的物质的量与加入NaOH溶液体积的关系图:
填空题 (15分)含铬污水处理是污染治理的重要课题。污水中铬元素以Cr2O72-和CrO42-形式存在,常见除铬基本步骤是:

(1)加酸可以使CrO42-转化为Cr2O72-:?2CrO42- + 2H+ ?Cr2O72- + H2O
?Cr2O72- + H2O
若常温下pH=1溶液中Cr2O72-浓度为0.1 mol?L-1,Cr2O72-浓度是CrO42-浓度的10倍,该化学平衡常数K=??????。
(2)六价铬的毒性大约是三价铬的100倍,二氧化硫还原法是在酸性溶液中通SO2将Cr2O72-还原,反应的离子方程式为?????????????????????????????????。而后再加碱将Cr3+沉淀,已知常温下Ksp[Cr(OH)3] =10-32,要使c(Cr3+)降低到10-5mol?L-1,溶液的pH应升高到????。
(3)电解还原法是利用电解产生的Fe2+将Cr2O72-还原为Cr3+.电解装置所用的电极材料是碳棒和铁片,其中铁片连接直流电源的??????极。
(4)Cr(OH)3为绿色粘性沉淀,类似于Al(OH)3既溶于酸又能溶于强碱溶液。Cr(OH)3溶于稀硫酸的化学方程式为????????????????????????????????????????????????????。往100.00mL 0.1000 mol?L-1CrCl3溶液滴加1.000mol?L-1NaOH溶液, 请画出生成沉淀的物质的量与加入NaOH溶液体积的关系图:

本题答案:(1).1.0×105(2)3SO2 + Cr2O72- +
本题解析:
试题分析:(1)化学平衡常数 。(2)在酸性溶液中通SO2将Cr2O72-还原为Cr3+,根据电子守恒及电荷守恒、原子守恒可得反应的离子方程式为3SO2 + Cr2O72- + 2H+ = 2Cr3+ + 3SO42- + H2O;常温下Ksp[Cr(OH)3] =10-32, c(Cr3+)=10-5mol/L,c3(OH-)=10-32÷10-5=10-27.所以c(OH-)=10-9mol/L.则c(H+)=Kw÷c(OH-)=10-5mol/L,因此pH=5。(3)电解还原法是利用电解产生的Fe2+将Cr2O72-还原为Cr3+.电解装置所用的电极材料是碳棒和铁片,其中铁片若要失去电子变为Fe2+,则铁片要与电源的正极连接。Cr(OH)3与稀硫酸反应化学方程式为2Cr(OH)3 + 3H2SO4 = 2Cr2(SO4)3 + 3H2O。n(Cr3+)=0.1L×0.100mol/L=0.01mol.向该溶液中加入NaOH首先发生反应:Cr3++3OH-=Cr(OH)3↓当n(NaOH)= 0.03mol,即NaOH的体积为30ml时沉淀达到最大值,再加入NaOH溶液,发生反应:Cr(OH)3+ OH-= CrO2-+ 2H2O,此时又消耗NaOH的物质的量为0.01mol,即再消耗10ml.,达到40ml时,沉淀完全溶解。之后再滴加NaOH溶液,也不会发生反应。生成沉淀的物质 的量与加入NaOH溶液体积的关系图为
。(2)在酸性溶液中通SO2将Cr2O72-还原为Cr3+,根据电子守恒及电荷守恒、原子守恒可得反应的离子方程式为3SO2 + Cr2O72- + 2H+ = 2Cr3+ + 3SO42- + H2O;常温下Ksp[Cr(OH)3] =10-32, c(Cr3+)=10-5mol/L,c3(OH-)=10-32÷10-5=10-27.所以c(OH-)=10-9mol/L.则c(H+)=Kw÷c(OH-)=10-5mol/L,因此pH=5。(3)电解还原法是利用电解产生的Fe2+将Cr2O72-还原为Cr3+.电解装置所用的电极材料是碳棒和铁片,其中铁片若要失去电子变为Fe2+,则铁片要与电源的正极连接。Cr(OH)3与稀硫酸反应化学方程式为2Cr(OH)3 + 3H2SO4 = 2Cr2(SO4)3 + 3H2O。n(Cr3+)=0.1L×0.100mol/L=0.01mol.向该溶液中加入NaOH首先发生反应:Cr3++3OH-=Cr(OH)3↓当n(NaOH)= 0.03mol,即NaOH的体积为30ml时沉淀达到最大值,再加入NaOH溶液,发生反应:Cr(OH)3+ OH-= CrO2-+ 2H2O,此时又消耗NaOH的物质的量为0.01mol,即再消耗10ml.,达到40ml时,沉淀完全溶解。之后再滴加NaOH溶液,也不会发生反应。生成沉淀的物质 的量与加入NaOH溶液体积的关系图为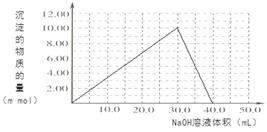 。
。
本题所属考点:【反应速率与平衡的有关计算】
本题难易程度:【一般】
To know how to wait is the great secret of success. 懂得如何等待是成功的重要秘诀.