微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
填空题 (14分)氢能是重要的新能源。储氢作为氢能利用的关键技术,是当前关注的热点之一。
(1)氢气是清洁能源,其燃烧产物为__________。
(2)NaBH4是 一种重要的储氢载体,能与水反应达到NaBO2,且反应前后B的化合价不变,该反应的化学方程式为___________,反应消耗1mol NaBH4时转移的电子数目为__________。
(3)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢: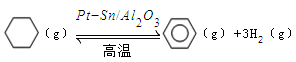 。某温度下,向恒容密闭容器中加入环己烷,起始浓度为a mol/L,平衡时苯的浓度为bmol/L,该反应的平衡常数K=_____。
。某温度下,向恒容密闭容器中加入环己烷,起始浓度为a mol/L,平衡时苯的浓度为bmol/L,该反应的平衡常数K=_____。
(4)一定条件下,题11图示装置可实现有机物的电化学储氢(忽略其它有机物)。
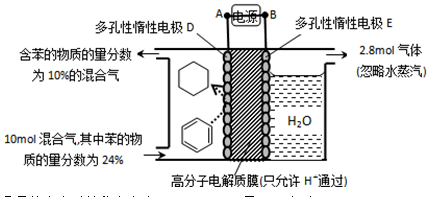
①导线中电子移动方向为____________。
②生成目标产物的电极反应式为_________。
③该储氢装置的电流效率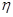 =_____(
=_____(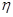 =
= ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)
填空题 (14分)氢能是重要的新能源。储氢作为氢能利用的关键技术,是当前关注的热点之一。
(1)氢气是清洁能源,其燃烧产物为__________。
(2)NaBH4是一种重要的储氢载体,能与水反应达到NaBO2,且反应前后B的化合价不变,该反应的化学方程式为___________,反应消耗1mol NaBH4时转移的电子数目为__________。
(3)储氢还可借助有机物,如利用环己烷和苯之间的可逆反应来实现脱氢和加氢: 。某温度下,向恒容密闭容器中加入环己烷,起始浓度为a mol/L,平衡时苯的浓度为bmol/L,该反应的平衡常数K=_____。
。某温度下,向恒容密闭容器中加入环己烷,起始浓度为a mol/L,平衡时苯的浓度为bmol/L,该反应的平衡常数K=_____。
(4)一定条件下,题11图示装置可实现有机物的电化学储氢(忽略其它有机物)。

①导线中电子移动方向为____________。
②生成目标产物的电极反应式为_________。
③该储氢装置的电流效率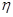 =_____(
=_____(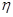 =
= ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位)
本题答案:(1)水或H2O?(2)NaBH4+2H2O=NaBO2+4
本题解析:
试题分析:(1)氢气的燃烧产物是水。
(2)反应前后B元素的化合价不变,则反应前后B元素的化合价均是+3价,因此反应前NaBH4中氢元素的化合价是-1价。水中氢元素的化合价是+1价,因此反应中还有氢气生成,则反应的化学方程式为NaBH4+2H2O=NaBO2+4H2↑。NaBH4中氢元素的化合价从-1价升高到0价,因此1molNaBH4在反应中失去4mol电子,其数目是4NA或2.408×1024。
(3)平衡时苯的浓度是b mol/L,则根据反应的方程式可知消耗环戊烷的浓度是b mol/L,生成 氢气的浓度是3 b mol/L,,平衡时环戊烷的浓度为(a-b)mol/L。由于化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,则该温度下反应的平衡常数为 =
=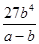 mol3/L3。
mol3/L3。
(4)①苯生成环戊烷属于得氢反应,因此是还原反应,即电极D是阴极,电极E是阳极,因此导线中电子的流动方向是A→D。
②苯得到电子生成环戊烷是目标产物,由于存在质子交换膜,所以氢离子向阴极移动,则电极反应式为C6H6+6H++6e-=C6H12。
③阳极生成2.8mol气体,该气体应该是阳极OH-放电生成的氧气,则转移电子的物质的量=2.8mol×4=11.2mol。设阴极消耗苯的物质的量是xmol,则同时生成 xmol环戊烷,根据电极反应式C6H6+6H++6e-=C6H12可知得到电子是6xmol,根据电子守恒可知,阴极生成氢气是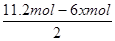 =5.6mol-3xmol,所以
=5.6mol-3xmol,所以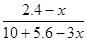 ?=0.1,解得x=1.2,因此储氢装置的电流效率=
?=0.1,解得x=1.2,因此储氢装置的电流效率= ×100%=64.3%。
×100%=64.3%。
本题所属考点:【反应速率与平衡的有关计算】
本题难易程度:【一般】
It takes two to speak truth-one to speak and another to hear. 说真话要有两个人——一个说,一个听。