微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
简答题 (14分)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示:
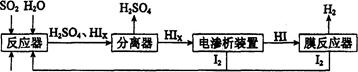
回答下列问题:
(1)在反应器来源:91考试网 91ExaM.org中发生反应的化学方程式是______________。
(2)在膜反应器中发生反应:2HI(g) H2(g)十I2 △H>0。若在一定条件下密闭容器中加入l mol HI(g),? n(H2)随时间(t)的变化如图所示:
H2(g)十I2 △H>0。若在一定条件下密闭容器中加入l mol HI(g),? n(H2)随时间(t)的变化如图所示:

①该温度下,反应平衡常数K=_______,若升高温度,K值将_______
(填“增大”、“减小”或“不变?’)。
②用化学平衡原理解释使用膜反应器及时分离出H2的目的是___________________
(3)电渗析装置如下图所示:

①结合电极反应式解释阴极区HIx转化为HI的原理是______________________________
②该装置中发生的总反应的化学方程式是________________________
(4)上述工艺流程中循环利用的物质是_________。
简答题 (14分)工业上用硫碘开路循环联产氢气和硫酸的工艺流程如下图所示:

回答下列问题:
(1)在反应器中发生反应的化学方程式是______________。
(2)在膜反应器中发生反应:2HI(g) H2(g)十I2 △H>0。若在一定条件下密闭容来源:91考试网 91Exam.org器中加入l mol HI(g),? n(H2)随时间(t)的变化如图所示:
H2(g)十I2 △H>0。若在一定条件下密闭容来源:91考试网 91Exam.org器中加入l mol HI(g),? n(H2)随时间(t)的变化如图所示:

①该温度下,反应平衡常数K=_______,若升高温度,K值将_______
(填“增大”、“减小”或“不变?’)。
②用化学平衡原理解释使用膜反应器及时分离出H2的目的是___________________
(3)电渗析装置如下图所示:

①结合电极反应式解释阴极区HIx转化为HI的原理是______________________________
②该装置中发生的总反应的化学方程式是________________________
(4)上述工艺流程中循环利用的物质是_________。
本题答案:(1)SO2+xI2+2H2O=H2SO4+2HIx;(2)
本题解析:
试题分析:(1)根据流程示意图可知:在反应器中发生反应的化学方程式是SO2+xI2+2H2O=H2SO4+2HIx;(2)①该温度下,反应平衡常数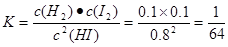 ;由于该反应的正反应是吸热反应,实验根据平衡移动原理,升高温度,化学平衡向吸热反应方向移动,实验化学平衡常数K值将增大;②使用膜反应器及时分离出H2,也就是减小了生成物的浓度,根据平衡移动原理,化学平衡向正反应方向移动,可以产生更多的生成物,从而提高了HI的分解率。(3)①由于阴极是与电源的负极连接的电极,有较多的负电荷,所以在阴极上发生反应:Ix-+(x-1)e-=xI-,根据同种电荷相互排斥,异种电荷相互吸引的原则,阳极区的H+通过交换膜进入阴极区,从而生成HI溶液;②根据电极反应式可知:该装置中发生的总反应的化学方程式是2HIx
;由于该反应的正反应是吸热反应,实验根据平衡移动原理,升高温度,化学平衡向吸热反应方向移动,实验化学平衡常数K值将增大;②使用膜反应器及时分离出H2,也就是减小了生成物的浓度,根据平衡移动原理,化学平衡向正反应方向移动,可以产生更多的生成物,从而提高了HI的分解率。(3)①由于阴极是与电源的负极连接的电极,有较多的负电荷,所以在阴极上发生反应:Ix-+(x-1)e-=xI-,根据同种电荷相互排斥,异种电荷相互吸引的原则,阳极区的H+通过交换膜进入阴极区,从而生成HI溶液;②根据电极反应式可知:该装置中发生的总反应的化学方程式是2HIx (x-1)I2+2HI;(4)在上述工艺流程中循环利用的物质是I2。
(x-1)I2+2HI;(4)在上述工艺流程中循环利用的物质是I2。
本题所属考点:【反应速率与平衡的有关计算】
本题难易程度:【一般】
Popularity?It's glory's small change. 名望吗?那不过是光荣的零头.